Les études d’identification de biomarqueurs d’efficacité de l’immunothérapie (IT) ont montré que la charge mutationnelle tumorale (TMB) ainsi que l'expression de PD-L1 permettent d’isoler, au moins en partie, les patients qui tireront un bénéfice clinique d’un traitement par anti-PD-(L)1 (1). Ces marqueurs d’efficacité ont malheureusement leur limite. L’article publié le 2 Avril dernier sur l’application, montre qu’un TMB>10 n’est prédictif de la réponse à l’IT qu’à l’exception des cancers MSI, POLE/POLD1 et des tumeurs ORL, bronchique et mélanome (2). Outre le TMB et l’expression de PD-L1, des modèles de prédiction basés sur l’étude d’expression des gènes ont également été proposés. La plupart de ces signatures transcriptomiques permettent d’identifier les tumeurs au microenvironnement inflammatoire, caractérisées par une forte expression des gènes associés à la présentation de l’antigène, à la réponse T cytotoxique, aux points de contrôle immunitaire et à la signalisation des interférons de types I (IFNα/β) et II (IFNγ) (3,4,5). Le gène codant pour la protéine CXCL10 est très souvent identifié dans ces signatures et constitue un élément clé de la réponse immunitaire anti-tumorale. Intéressons-nous de plus prêt à sa biologie et aux stratégies thérapeutiques actuellement envisagées pour induire son expression.
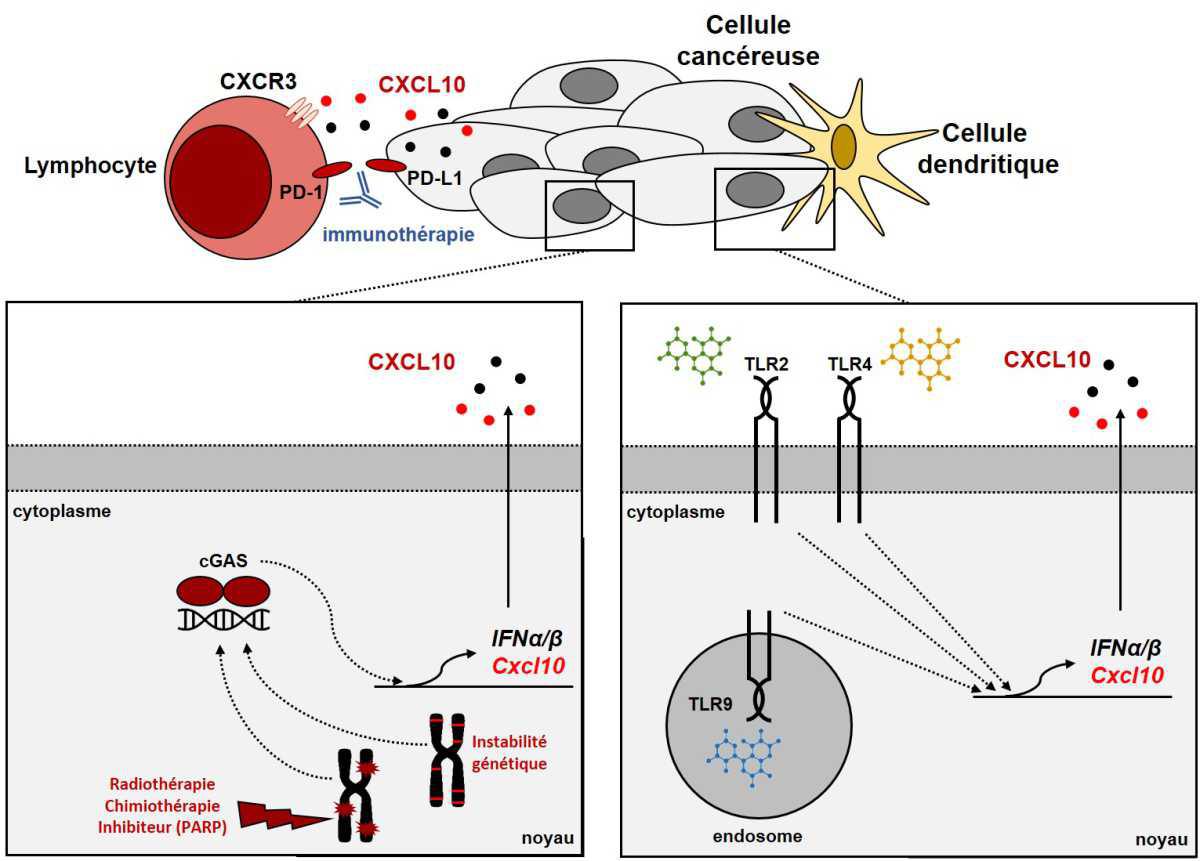
CXCL10 est une petite protéine de 8,7 kDa faisant partie de la famille des chimiokines. Elle peut être secrétée par un grand nombre de type cellulaire et son rôle principal est d’attirer dans le microenvironnement tumoral, par chimiotactisme et le récepteur CXCR3, les cellules de l’immunité telle que les lymphocytes Natural Killer, les Th1 ou encore les T-CD8+. Les tumeurs exprimant fortement cette chimiokine sont donc davantage infiltrées en cellules immunitaires et plus sensibles aux inhibiteurs de checkpoints immunitaires. CXCL10 est très souvent associée à la présence d’interférons de types I (IFNα/β). Ces derniers peuvent être exprimés dans un contexte d’infection, après reconnaissance de protéines ou d’acides nucléiques d’origine bactérienne ou virale appelés PAMPs (Pathogen-Associated Molecular Patterns). Les lésions tissulaires de nature non-infectieuse peuvent aussi augmenter la libération de molécules de danger appelées DAMPs (Damage Associated Molecular Pattern) favorisant l’expression des interférons et de CXCL10. Qu’ils s’agissent des PAMPs ou des DAMPs, tous peuvent être reconnus par les cellules de l’hôte et/ou les cellules tumorales par une multitude de senseurs intra/extracellulaires appelés PRRs (Pattern Recognition Receptors). Induire CXCL10 dans le microenvironnement tumoral par stimulation directe ou indirecte de ces récepteurs est une stratégie largement explorée actuellement pour sensibiliser les tumeurs froides à l’immunothérapie (6).
L’activation directe des PRRs par des agonistes synthétiques est largement explorée en recherche préclinique et clinique en association avec les anti-CTLA4 ou les anti-PD-(L)1. Par exemple, l’utilisation de la thérapie par le Bacillus Calmette-Guérin (BCG), permettant l’activation de TLR2/4/9 et NOD2, en association avec le pembrolizumab est en cours d’évaluation, en phase III (NCT03711032), suite à des résultats très prometteurs en phase II dans le cancer de la vessie non invasif (7). Citons un autre exemple dans les mélanomes résistants aux anti-PD1, et l’utilisation d’un agoniste de TLR9, le tilsotolimod, en association avec l’ipilimumab. Les résultats de phase I et II ont montré des signaux d’activités biologiques intéressants, avec une expression induite de l’IFNα et d’un recrutement NK et CD8 plus important dans les tumeurs grâce à l’activation de TLR9. Le taux de réponse objective obtenu en phase II a permis d’initier une phase III en cours actuellement (NCT03445533)(8).
L’activation des PRRs peut survenir de manière indirecte. L’instabilité génétique peut avoir pour conséquence d’augmenter la quantité d’ADN génomique dans le cytoplasme de la cellule cancéreuse. La présence de cet ADN est un signal de danger puissant qui mime la présence d’un virus à ADN. Le PRR alors impliqué est le senseur cGAS, capable d’activer très rapidement la sécretion d’interférons et de CXCL10. Ce phénomène explique en partie l’infiltration plus importante en lymphocytes des tumeurs MSI, POLE/POLD1. Il est aussi possible d’agir directement sur l’expulsion de l’ADN nucléaire, grâce à l’utilisation de la radiothérapie, de certaines chimiothérapies (anthracycline, sels de platine) ou d’inhibiteurs ciblant les voies de réparation de l’ADN (PARP, ATM/ATR, DNA-PK). Cette stratégie d’induction de CXCL10 est à l’origine d’association thérapeutique avec de l’immunothérapie en cours d’évaluation. Au CGFL, l’essai de phase II GUIDTOREPAIR évaluant l’association olaparib (inhibiteur de PARP) et durvalumab/tremelimumab en est un exemple (NCT04169841)(9).
Un travail important reste à accomplir pour identifier les associations les moins toxiques et les plus efficaces, mais également les mécanismes de résistances limitant l’activation des PRRs et la sécrétion de CXCL10 ! Alors, tous à nos pipettes !!!