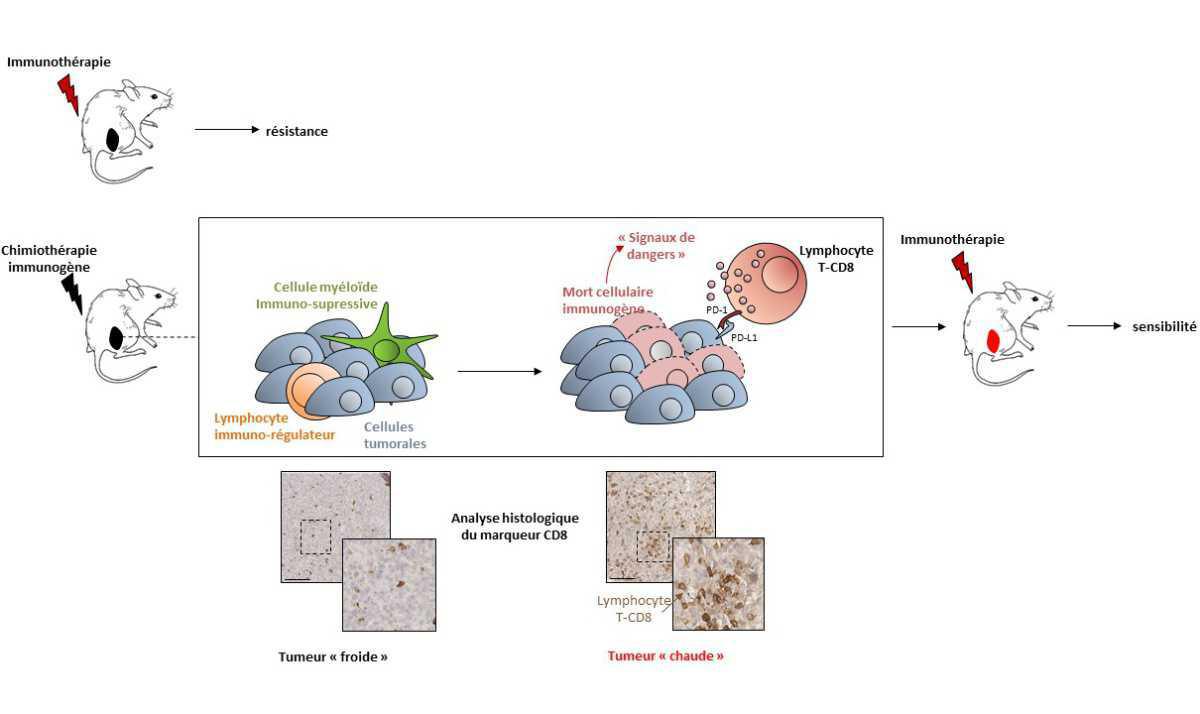
Jusqu'au début des années 2010, le traitement médical des cancers était principalement basé sur l'effet cytotoxique des chimiothérapies. Cette stratégie thérapeutique, qui bien souvent ne permet pas un contrôle durable de la maladie, a pour objectif d'éliminer un maximum de cellules cancéreuses en ciblant de manière directe, mais peu spécifique, les processus de la division cellulaire ou encore de la réplication de l'ADN. L’immunothérapie par inhibition des points de contrôle de l’immunité tels que PD-1 ou CTLA-4, a complétement bouleversé les codes de la prise en charge du cancer, en ne ciblant plus directement la cellule tumorale mais en stimulant les défenses immunitaires qui assureront une action cytotoxique spécifique. Le bénéfice en survie obtenu grâce à cette stratégie a largement favorisé son déploiement en clinique, en particulier dans le cancer bronchique et le mélanome. Malheureusement, ce bénéfice en survie n’est obtenu que pour un sous-groupe de tumeurs dites « chaudes » ou « immunosurveillées », caractérisées par une forte expression de PD-L1 et une infiltration importante en cellules immunitaires telles que les lymphocytes T CD8 cytotoxiques. Pour les tumeurs dites « froides » ou « non-immunosurveillées », il est dès lors indispensable d’identifier des stratégies thérapeutiques permettant de favoriser le recrutement immunitaire, de manière à les rendre sensibles à l’immunothérapie. C’est dans ce contexte que les chimiothérapies peuvent avoir un rôle à jouer, en particulier les chimiothérapies dites « immunogènes ». Voyons pourquoi !
On dit qu’une chimiothérapie est « immunogène » lorsqu’elle a la capacité de stimuler une réponse immunitaire spécifique à la tumeur. Cette notion n’est pas si nouvelle : au milieu des années 2000, des observations réalisées chez la souris montrent que les effets anti-tumoraux de certaines chimiothérapies, comme les anthracyclines, sont liés à la présence du système immunitaire. L’expérience est simple mais brillante : la croissance tumorale est mesurée après traitement par doxorubicine dans un groupe de souris immunocompétentes et un groupe de souris immunodéficiences (incapables de générer une réponse lymphocytaire T). Résultats : l’effet anti-tumoral de la doxorubicine est bien moindre en l’absence de lymphocytes T. Conclusion : même si la doxorubicine est un agent servant avant tout à inhiber directement la prolifération cancéreuse, elle est aussi capable d’induire une réponse immunitaire anti-tumorale ayant un rôle thérapeutique. Depuis, ces observations ont été étendues à d’autres drogues et les mécanismes biologiques sous-jacents à cet effet ont été démembrés, permettant d’identifier deux mécanismes principaux. Premièrement, les chimiothérapies peuvent induire une réponse immunitaire en levant les « freins » de l’immunité, par diminution des cellules immunosuppressives tels que les lymphocytes T régulateurs, les macrophages ou les cellules myéloïdes immatures (cyclophosphamide, 5-FU, gemcitabine, trifluridine/tipiracile). Deuxièmement, elles peuvent aussi induire une mort des cellules cancéreuses, dite « immunogène », lors de laquelle des « signaux de dangers » seront émis en vue d’alerter le système immunitaire, provoquant alors l’activation et le recrutement au sein de la tumeur des lymphocytes T cytotoxiques (oxaliplatine, anthracycline). Chez la souris, il est ainsi possible de sensibiliser de façon prolongée des tumeurs résistantes à l’immunothérapie en administrant de manière concomitante une chimiothérapie immunogène.
Chez l’homme, ce concept a pu être validé très récemment dans le cancer bronchique avec l’association en première ligne métastatique anti-PD-1 et chimiothérapie par sel de platine et pemetrexed (1). Des données préliminaires encourageantes ont été présentées l’an passé au congrès de l’ASCO avec l’association 5-FU/oxaliplatine et double immunothérapie par anti-PD-L1 et anti-CTLA4 dans le cancer du côlon métastatique MSS (2). Il reste encore un grand travail de modélisation préclinique à mener pour pour identifier de nouvelles associations synergiques et comprendre les mécanismes de résistance dans les cancers pour lesquelles chimiothérapie immunogènes et immunothérapie reste inefficace (pancréas, cancer du sein triple négatifs).