Définitions ?
- Mucite buccopharyngée : lésions inflammatoires ou ulcérées de l’épithélium oropharyngé. Peut toucher l’intégrité du tractus digestif de la bouche à l’anus.
- Les termes de mucite et de stomatite sont souvent employés de façon interchangeable. L’ESMO recommande de réserver le terme de mucite aux inflammations de la muqueuse en lien avec la chimiothérapie et/ou la radiothérapie et le terme stomatite aux dommages de la muqueuse liés aux thérapies ciblées. La stomatite inclut les altérations du goût, de la sensibilité, la xérostomie et les douleurs associées ou non à des lésions orales décrites avec les thérapies ciblées.
- La candidose oropharyngée (COP) correspond à une prolifération exagérée d’un champi-gnon commensal du tube digestif : le candida. Elle peut se manifester sous forme d’un mu-guet, de perlèche ou sous forme érythémateuse avec inflammation atrophique de la mu-queuse.
Quelle fréquence ?
Chimiothérapie-radiothérapie :
- 32% des patients traités par chimiothérapie conventionnelle
- Radiothérapie ORL : 85% de mucite de grade3-4 – 1er facteur dose limitant
- Mucite gastro-intestinale : 75% des patients recevant une greffe de cellules souche hémato-poïétique
- Mucite orale et gastro intestinale : Fréquent avec capécitabine, xéloda, irinotecan. 25% de diarrhées de grade 3-4 chez les patients recevant un protocole de type FOLFOX ou FOL-FIRI pour un cancer colo rectal
Stomatite et thérapie ciblée : (méta-analyse Elting et al.)
- Principaux agents responsables : erlotinib, sorafenib, sunetinib, lapatinib, everolimus, béva-cizumab.
- Mucite du tractus gasto-intestinal : risque 2 à 8X plus élevé qu’avec des thérapies conven-tionnelles
- Une forme particulière associée aux inhibiteurs de mTOR (afinitor® ou everolimus) appelée mIAS pour mTOR Inhibitors Associated Stomatis a été décrite. Il s’agit de l’effet se-condaire le plus fréquemment rencontré avec cette classe médicamenteuse (73,4% des patients – 27,3% de réduction de dose)
Quels mécanismes ?
Deux phénomènes interviennent dans la mucite liée à la chimiothérapie et à la radiothérapie
- Action directe de la chimiothérapie ou des radiations ionisantes sur la muqueuse
- Phénomène inflammatoire local majoré par la neutropénie et la présence d’infections locales (virus, bactéries, fongiques)
Mucite liée aux thérapies ciblées : La physiopathologie est mal connue et différentes de celles des mucites radio ou chimio induites. Elles ont été beaucoup moins caractérisées hormis pour les inhi-biteurs de mTOR où il s’agirait d’un effet direct de l’inhibition des voies impliquées dans la crois-sance cellulaire et la réparation cellulaire.
Quels sont les facteurs influençant la survenue de mucite ?
- Pendant la radiothérapie, le volume total, la dose par fraction et la dose totale influence la survenue de mucite. De même l’adjonction d’une chimiothérapie à la radiothérapie majore le risque de mucite.
- La récurrence des traitements augmente la survenue d’une mucite ; ainsi les patients qui ont eu une mucite lors de leur première cure de chimiothérapie voient leur risque de récidive multiplié par 4 lors de la deuxième cure.
- Les autres facteurs de risque sont : antécédents de mucite, mauvaise hygiène bucco-dentaire (caries, péridontopathies), l’âge, exposition tabac ou alcool, le diabète, la cortico-thérapie.
Quelques conseils de prévention ?
En terme de prévention de la mucite, sont admis l’intérêt de :
- la cryothérapie (application de glaçons pendant 30 min après bolus de 5FU (niveau de preuve II et le melphalan niveau de preuve III)
- le lazer basse énergie (niveau de preuve III pour la radiothérapie en l’absence de chimiothé-rapie ORL et niveau de preuve II en cas de chimiothérapie intensive avec auto greffe de cellules souches)
- le zinc per os (25 à 50 mg/jour) (niveau de preuve III pour la radiothérapie ORL)
- les bains de bouche avec le benzydamine (niveau de preuve I en cas de radiothérapie ORL sans chimiothérapie, dose de 50 Gy)
- Le palifermin (60 μg/kg/j pendant 3 jours avant et 3 jours après chimiothérapie) en cas de chimiothérapie intensive avec TBI et greffe de cellules souches pour une maladie hémato-logique (niveau de preuve II).
En raison de l’insuffisance de preuve, il ne peut être donné de recommandations fortes pour les soins locaux en prévention de la mucite buccale liée à la radiothérapie ou à la chimiothérapie (solution saline, bicarbonate de sodium, mélanges divers, phosphate de calcium ou chlorexidine). L’ESMO/ISOO recommande donc des bains de bouche à l’eau plate, mieux supportés par les patients. En revanche, en ce qui concerne les thérapies ciblées, l’ESMO/ISOO recommande l’utilisation de bains de bouche à base de solution saline du fait de la charge microbienne pouvant favoriser l’apparition de blessure locale.
La prévention des mucites va donc essentiellement reposer :
- des soins bucco dentaires avant l’instauration du traitement
- le maintien hygiène buccodentaire pendant le traitement
- une alimentation adaptée (nécessité d’une éducation et une participation du patient)
Bilan bucco dentaire:
Un bilan buccodentaire doit être réalisé avant instauration du traitement. Au mieux, le patient sera adressé à son dentiste.
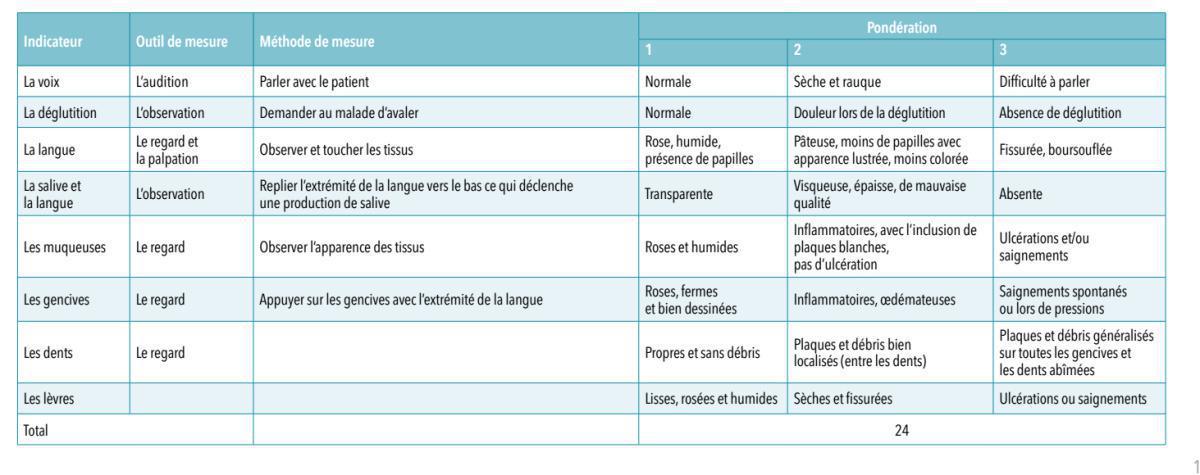
Un examen attentif de la cavité buccale est préconisé. Une échelle particulière l’OAG (Oral Assessment Guide, présenté en annexe) a été élaborée et permet d’évaluer l’état buccal avant la mise en route du traitement. La grille comprend des graduations de 1 à 3. Le résultat final est obtenu en additionnant le score des différents items. Il s’étend entre 8 (bouche normale) et 24, score le plus élevé correspondant à une bouche très atteinte.
Maintenir une bonne hygiène bucco dentaire et conseils alimentaires ( cf encadré)
Bien faire un bain de bouche : Les bains de bouche doivent être répétés le plus souvent possible, au moins 4 fois par jour. 15 mL de solution sont suffisants et doivent être utilisés en gargarisme pendant une minute au moins, après le brossage des dents. Rester à jeûn stricte pendant la demi-heure qui suit la réalisation du bain de bouche.
Traitement de la mucite :
| Prévention des mucites : Bilan dentaire pré-thérapeutique systématique (indispensable en cas d’irradiation de la tête et du cou) Information et éducation des patients Hygiène buccale avec : Bains de bouche 4 à 6 fois/jour Utilisation d’une brosse à dents souples après chaque repas Dentifrice non abrasif et sans additifs – Dentifrice sans menthol ou pédiatrique Nécessite de bien rincer sa brosse à dents après chaque usage et la remplacer tous les mois Pas de fil dentaire ni de cure dents En cas d’appareil dentaire : Enlever et nettoyer appareil après chaque repas Faire tremper appareil dans solution antiseptique effervescente renouvelée chaque jour Ne pas utiliser un appareil mal ajusté (Attention en cas de perte de poids) Maintenir une hydratation : Augmenter l’hydratation (2 litres par jour) : eux minérales, coca-cola, thé, tisane Chewing-gums, bonbons sans sucre, substituts salivaires et sialagogues Hydrater les lèvres (lanoline, beurre de cacao- vaseline CI si oxygénothérapie. |
Traitement de la mucite :
La prise en charge des mucites va essentiellement reposer sur les soins locaux, la prise en charge de la douleur et le support nutritionnel. Là encore, faute de preuve, il est difficile d’établir des re-commandations. La prise en charge sera adaptée à la clinique et au grade de la mucite.
Ce qui est admis par la MASCC :
L’utilisation de bains de bouche contenant 0,2% de morphine chez les patients traités par radio chimiothérapie ORL (niveau de preuve III)
Les bains de bouche contenant 0,5% de doxepine pour le traitement antalgique de la mucite buccale (niveau de preuve III).
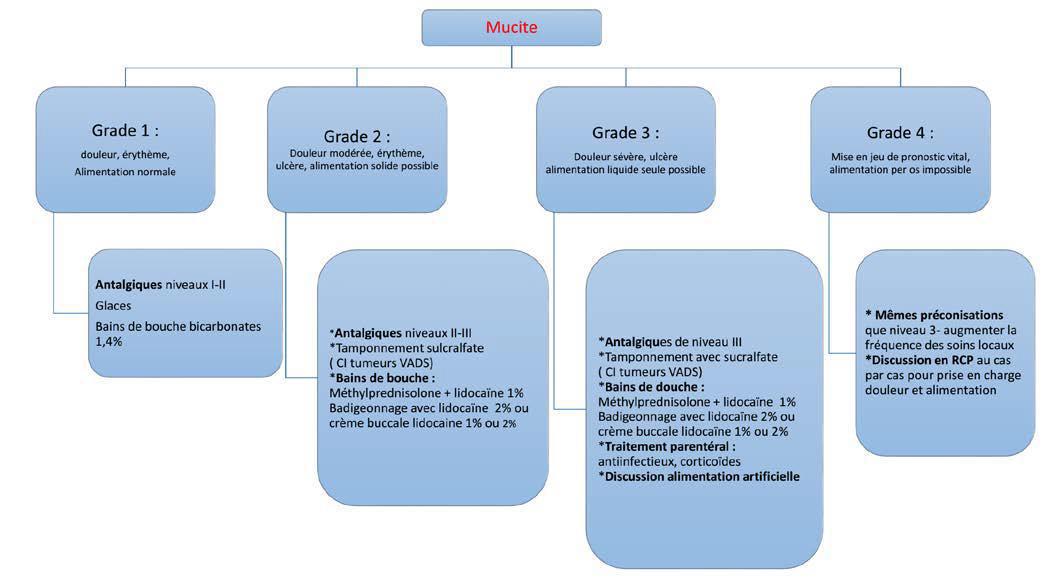
La prise en charge des mucites en fonction du grade est résumée dans organigramme ci-dessous (issus des référentiels de l’AFSOS).
Stomatite et inhibiteurs de mTOR (mIAS):
Il n’y a pas de recommandations validées pour la prise en charge des mIAS. Le groupe de travail essai OrOr (prise en charge préventive et curative des mucites sous everolimus) propose un pro-tocole de soins définis.
| Règles hygiéno diététiques en préventif :
Traitement curatif dès l’apparition d’un grade 1 :
Prise en charge précoce et symptomatique de la douleur et de l’inflammation :
|
Et la candidose oropharyngée (COP)?
L’examen endo buccal doit être systématique. Il existe plusieurs formes cliniques de la candidose oro-pharyngée : la forme pseudo-membraneuse (lésions blanchâtres détachables type muguet), la forme érythémateuse (lésions erythémateuses associées à des signes fonctionnels lors de la prise alimentaire) et la forme chronique (lésions végétantes, kératosiques, ou lésions atrophiques). La candidose peut également se manifester sous la forme de perlèches associées à des lésions rétrocommissurales.
NB : L’atteinte virale se manifeste sous forme de lésions ulcérées qu’il n’est pas toujours évident de différencier d’une mucite induite par la chimiothérapie. En cas de lésions ulcérées et symptomatologie persistante (grade III), un traitement anti-herpétique doit être mis en place.
Traitement de la candidose oropharyngée :
La liste des principaux antifongiques est présentée en annexe à la fin du chapitre.
- Le candida albicans est l’étiologie la plus fréquente des candidoses oropharyngées (78% des infections).
- La prévention de la candidose orpopharyngée va reposer sur le maintien d’une bonne hy-giène buccodentaire. Les gélules de fluconazole (Triflucan®) 100 et 200 mg ont obtenu l’AMM en situation préventive chez les sujets exposés au risque de neutropénie prolongée lors du traitement d’induction et de consolidation des leucémies aigues et subissant une al-logreffe de cellules souches. En dehors de cette indication, il n’y a pas d’indication à la prescription d’un traitement anti fungique préventif.
- Le traitement fera appel à un antifungique. Celui-ci devra être administré par voie locale en l’absence d’atteinte systémique. En effet, les recommandations sont d’utiliser l’antifungique en topique local ayant le moins d’interactions médicamenteuses possibles (miconazole et AVK) et le moins de résistance. C’est le fluconazole qui possède le profil de tolérance le mieux établi et c’est donc lui qui est recommandé en première intention (attention : résistance de candida kruséi et sensibilité diminuée à candida glabrata). En ce qui concerne le miconazole, un essai de non-infériorité a comparé le miconazole en cp mucoadhésif versus un gel oral et est en faveur d’une meilleure adhérence du cp mucoadhésif, qui est donc la forme recommandée pour cette spécialité.
- Les traitements systémiques seront à réserver à l’atteinte systémique. Dans cette indication, ce sont le fluconazole (IV, per os) ou l’itraconazole qui sont recommandés.
- En cas de perlèche, un traitement par antifungique local en crème doit être prescrit. La per-lèche candidosique est fréquemment associée à une perlèche à staphylocoque pour laquelle on utilisera de la fucidine pommade.
- Un prélèvement doit être réalisé en cas de persistance des symptômes à 14 jours malgré un traitement bien conduit, avant tout traitement systémique, en cas de perlèche.
- Les différents médicaments disponibles sont résumés dans l’encadré présenté en annexe.
Principaux antifongiques
| Antifungiques à action locale | ||
| Miconazole Loramyc® cp gingival mucoadhésif 50mg Daktarin® Gel buccal (1 cmesure: 62,5mg) Interaction avec AVK et sulfamides | 1 cp/jour 125 mg 3 à 4 fois/jour | 7 à 14 jours 7 à 15 jours |
| Amphotéricine B Fungizone® susp buvable (500 mg par c à café, pipette doseuse 1 ml: 100 mg) Fungizone® gel (à ouvrir dans la bouche) | 1,5 à 2 g par jour, soit 3 à 4 c à café par jour (3 à 4 prises par jour) 1,5 à 2g/jour soit 6 à 8 gel/jour en 2 à 3 prises | 15 à 21 jours
15 à 20 jours |
| Mycostatine Nystatine® Susp buvable, flacon avec mesure graduée en ml | Badigeonnage 4 à 6 fois/jour | Jusqu’à disparition des symptômes |
| Antifungiques à action systématique (candidose étendue, sévère, malades greffés en hématologie) | ||
| Fluconazole Triflucan® 50 mg gel Triflucan® susp buvable 50mg/5 mL (7 mesures de 50 mg par flacon) Triflucan® sol injectable 2mg/ml flacon de 50, 100, 200 ml Perturbation possible du bilan hépatique | 50mg/jour 1 mesure/jour
100mg/jour en IV sur 1 heure | 7 à 14 jours 7 à 14 jours Durée selon réponse clinique |
| Itraconazole Sporanox® sol buvable 100mg/mesure de 10 ml | 100 mg 2 fois/jour, à prendre en dehors des repas, laisser 20 sec dans la bouche puis avaler
200 mg 2 fois/jour si résistance au fluconazle | 7 jours
14 jours |
Oral assessment guide
Classification des mucites selon leur grade
| Mucite de grade 0 | Alimentation possible, pas de douleur, muqueuse normale |
| Mucite de grade 1 | Alimentation normale, douleur modérée, enanthème |
| Mucite de grade 2 | Alimentation solide encore possible, douleur enanthème, ulcérations non confluentes |
| Mucite de grade 3 | Alimentation liquide, douleur, énanthème diffus, ulcérations confluentes |
| Mucite de grade 4 | Aphagie, alimentation entérale sur sonde ou parentérale, douleur sévère, ulcérations confluentes |
Références bibliographiques :
Antunes HS et al., Blood 2007 ; 109 : 2250-5
Bensadoun RJ et al., Support Care Cancer 1999 ; 79 : 1864-9
Bensadoun RJ et al., Bull Cancer 2006 ; 93 :201-11
Boers-Doets CB et al. ; Future Oncol 2013; 9: 1883–1892.
Elting LS, al. Support Care Cancer 2013; 21: 3243–3254.
Groesche J et al., Biomed Anal 2006 ; 42 :362-6
Kashiwazaki H et al., Support Care Cancer 2011
Köstler WJ et al., CA Cancer J Clin 2001 ; 51 :290-315
Lescaille G. et al., Med Buccale Chir Buccale 2010 ; 16 : 171-176
McGuire DB et al. ;Support Care Cancer 2013; 21 : 3165–3177.
Peterson DE et al., Ann Oncol 2010 ; 21 : 261-265
Pilotte AP et al. ; Clin J Oncol Nurs 2011; 15: E83–E89.
Sonis S et al., Cancer 2010; 116: 210–215
Spielberger R et al., N Engl J Med 2004 ; 351 : 2590-8
Squier CA et al. ; J Natl Cancer Inst Monogr 2001;(29):7-15
Trotti A et al., Radiother Oncol 2003 ; 66 : 253-62
Vincent I et al., J Pharm Clin 1995 ; 14 : 106-11
Worthington HV et al., Cochrane Database Syst Rev 2010 Dec 8 ; (12) : CD000978