Dr Benjamin Auberger - Spécialiste en Oncologie médicale, Onco-urologie, Neuro-Oncologie, Séno-oncologie. Docteur en Médecine et en Pharmacie.
1) Résultats finaux de l’étude COSMIC-313 évoluant l’efficacité et la tolérance d’un traitement associant Cabozantinib Nivolumab et Ipilimumab en 1ère ligne métastatique du carcinome rénal à cellules claires. (Abstract 438 ; Laurence Albiges)
LE CONTEXTE :
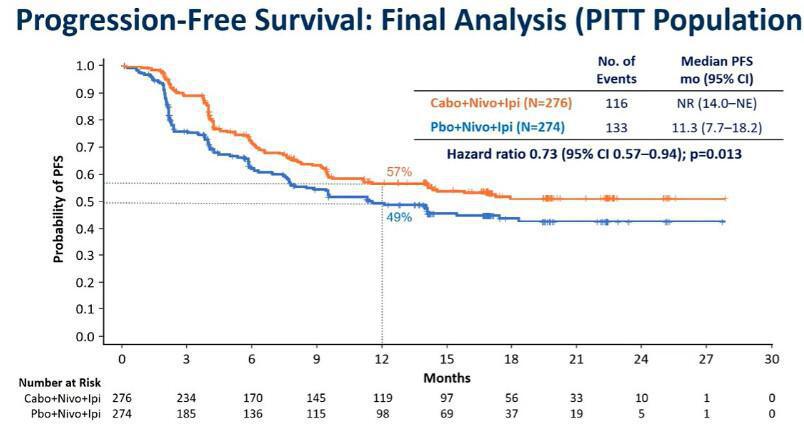
Suite aux dernières avancées, la recherche a continué d’explorer de nouvelles approches pour renforcer la prise en charge des patients atteints d’un cancer du rein métastatique. L’étape semblant la plus pertinente était d’intensifier davantage le traitement pour encore améliorer le devenir des malades. L’étude de phase 3 COSMIC-313 évaluait pour la 1ère fois l’efficacité et la tolérance d’une combinaison de référence (Nivolumab et Ipilimumab) face à un triplet avec le Cabozantinib chez les patients atteints d’un carcinome à cellules claires de pronostic intermédiaire ou défavorable. En dépit d’une amélioration significative mais encore immature de la survie sans progression (HR=0,73 ; IC95 % 0,57-0,94 ; p= 0,013), il n’existait qu’une augmentation marginale du taux de réponse objective par rapport au traitement de référence avec un faible taux de réponse complète dans les deux bras.
En l’absence des données matures de survie globale, il semblait difficile de prédire quelle place potentielle pouvait occuper cette combinaison de 2 immunothérapies et d’un inhibiteur de tyrosine kinase dans le paysage thérapeutique du cancer du rein métastatique. Les dernières données de cette étude concernant notamment l'analyse finale de l'OS ont été présentées par Laurence Albiges.
METHODES ET RESULTATS :
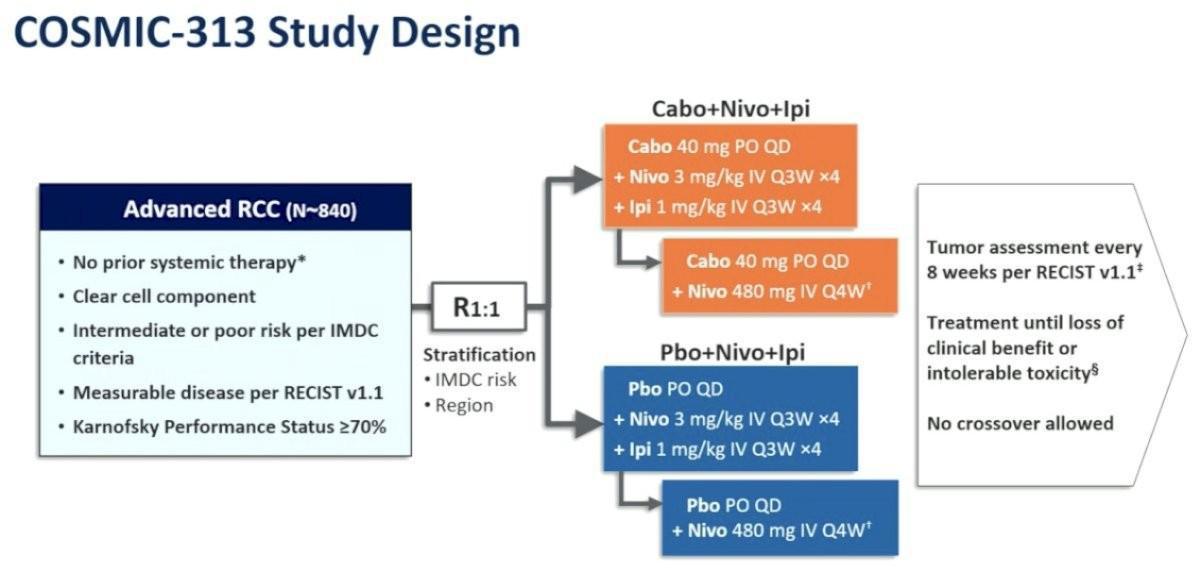
Les patients inclus dans l’étude COSMIC-313, atteints d’un carcinome rénal avancé à risque intermédiaire ou élevé selon l’IMDC et n’ayant jamais été traités, ont été randomisés pour recevoir soit Cabozantinib à 40 mg une fois par jour soit un placebo. Tous les malades recevaient un traitement par immunothérapie (Nivolumab 3 mg/kg IV et Ipilimumab 1 mg/kg IV toutes les 3 semaines pendant 4 cycles suivis de Nivolumab 480 mg IV toutes les 4 semaines jusqu’à 2 ans). Le critère de jugement principal était la survie sans progression (PFS), évaluée par un comité indépendant en aveugle selon RECIST 1.1, chez les 550 premiers patients randomisés. La survie globale (OS) chez tous les patients randomisés était un critère secondaire. Une analyse exploratoire de biomarqueurs a été effectué dans le but d'identifier des sous-ensembles immunitaires (à partir de données d’un séquençage RNA) éventuellement associés à une amélioration de la survie globale dans les 2 bras.
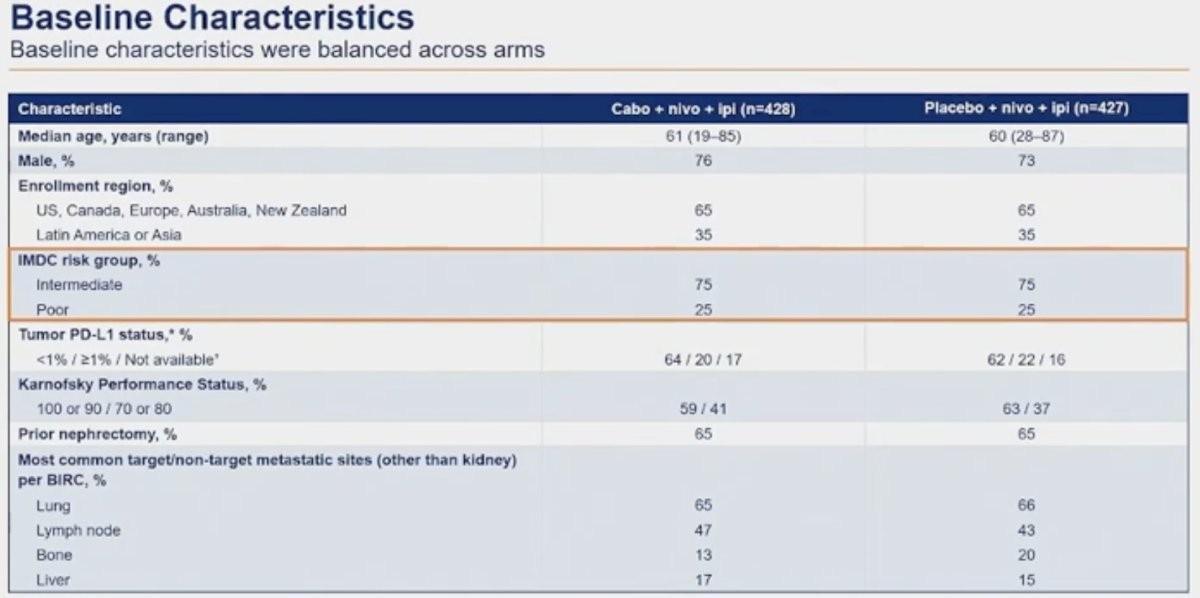
Au total, 855 patients ont été randomisés (428 dans le groupe Cabozantinib, Nivolumab et Ipilimumab et 427 dans le groupe standard). 75% des malades étaient porteur d’un cancer du rein avec un risque IMDC intermédiaire.
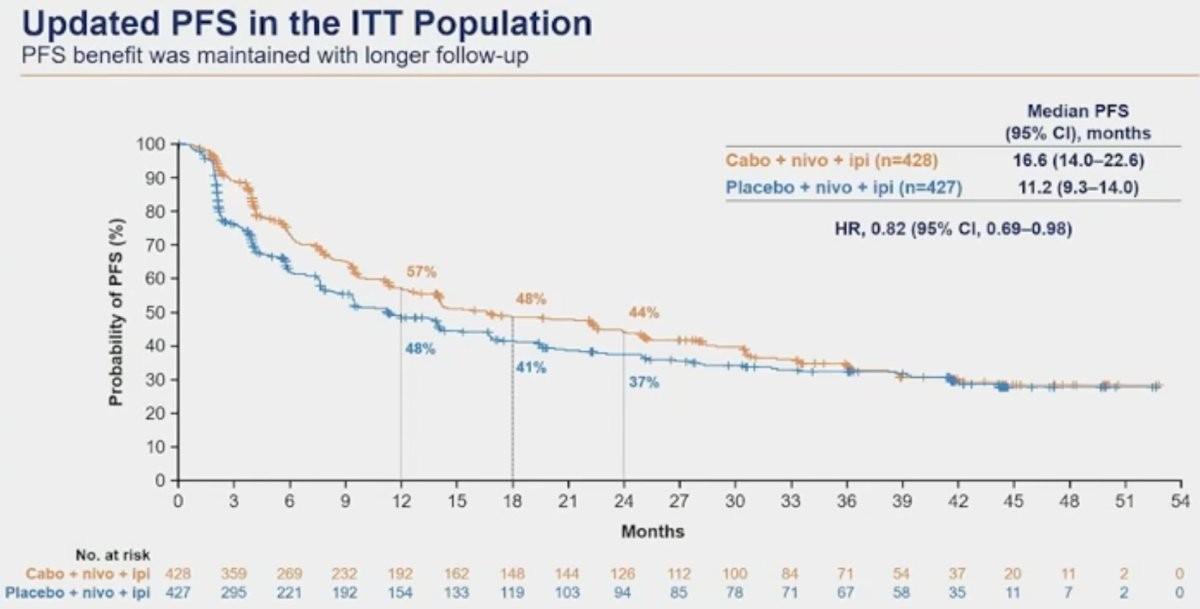
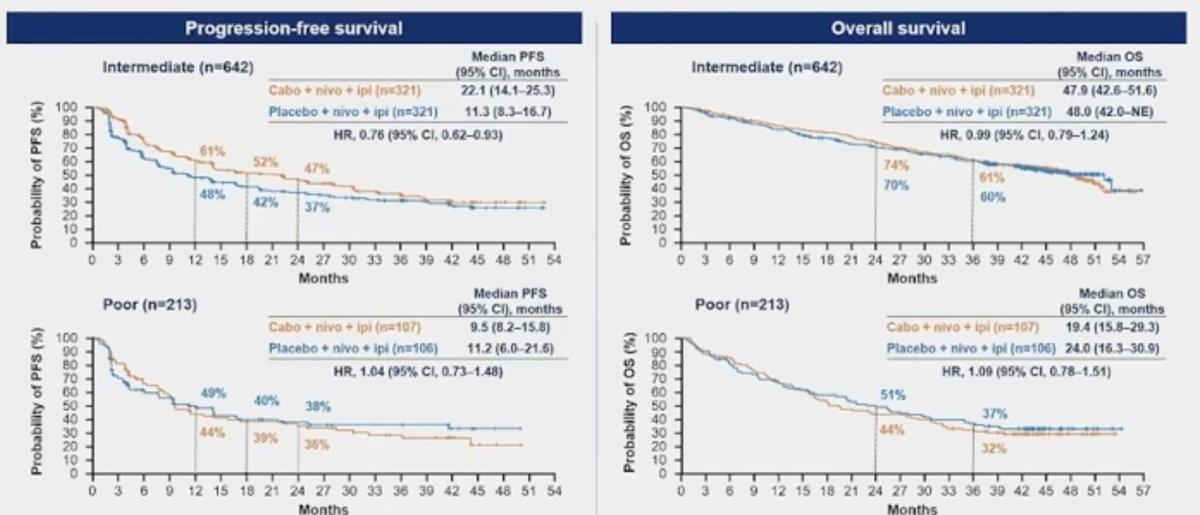
Avec un suivi médian de 45,0 mois, le bénéfice significatif en PFS se maintenait en faveur du bras expérimental dans la population en ITT avec une médiane de survie sans progression de 16,6 mois (14,0–22,6) versus 11,2 mois (9,3–14,0) (HR=0,82 ; IC95% 0,69–0,98), notamment dans le groupe IMDC intermédiaire (22,1 mois vs 11,3 mois ; HR=0,76 ; IC95% 0,62-0,93).
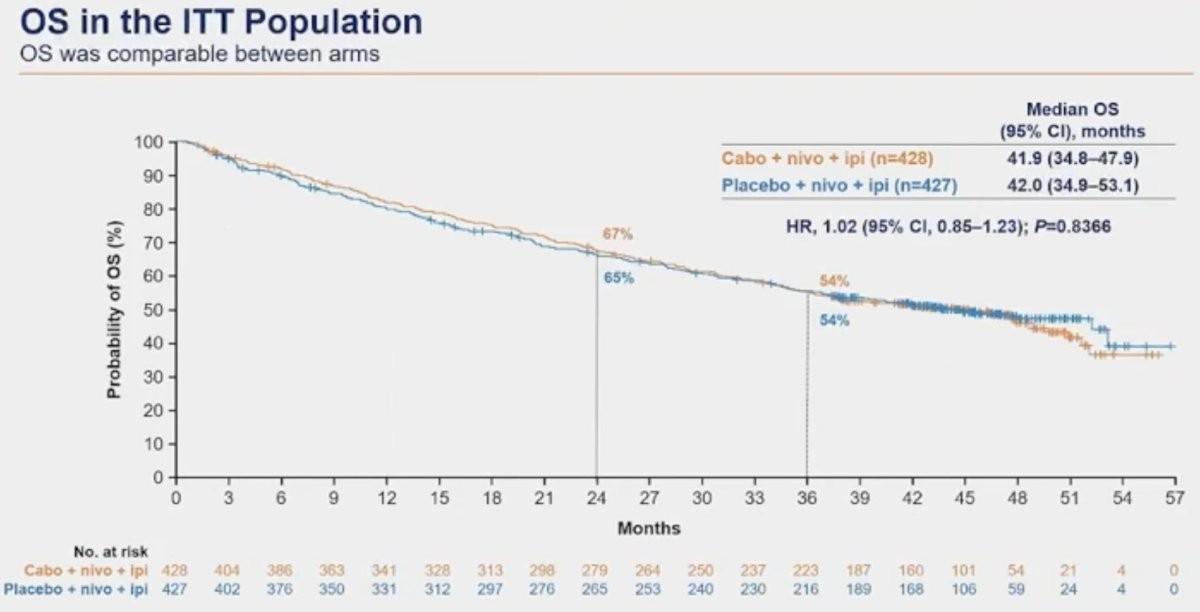
Concernant la survie globale, aucune différence significative n’a été observée dans les 2 bras que ce soit dans la population en intention de traiter (41,9 mois vs 42,0 mois ; HR=1,02 IC95% 0,85–1,23 ; p=0,84) ou selon les groupes de risque IMDC.
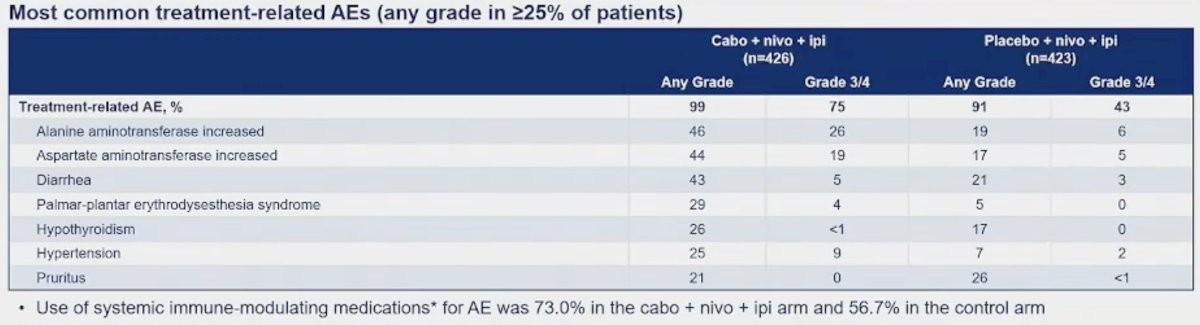
Le taux de réponse objective était plus élevé avec le triplet (46 % vs 37 % dont 42% vs 33% des patients avec une réponse partielle) et l’incidence de maladie progressive d’emblée plus faible (8 % vs 20 %). Les effets indésirables liés au traitement (TEAEs) de grade 3/4 étaient de 75 % avec le Cabozantinib contre 43 % dans le groupe standard avec notamment une augmentation des transaminases supérieure à 20%.
Le taux de réponse objective était plus élevé avec le triplet (46 % vs 37 % dont 42% vs 33% des patients avec une réponse partielle) et l’incidence de maladie progressive d’emblée plus faible (8 % vs 20 %). Les effets indésirables liés au traitement (TEAEs) de grade 3/4 étaient de 75 % avec le Cabozantinib contre 43 % dans le groupe standard avec notamment une augmentation des transaminases supérieure à 20%.
Seulement 58% des patients dans le bras expérimental ont pu recevoir les 4 cycles initiaux d’immunothérapie (vs 74%) et 92% des malades ont dû recevoir un traitement avec une adaptation posologique (vs 76%) en lien avec les TEAEs (avec 49% vs 26% d’arrêt d’un des composants).
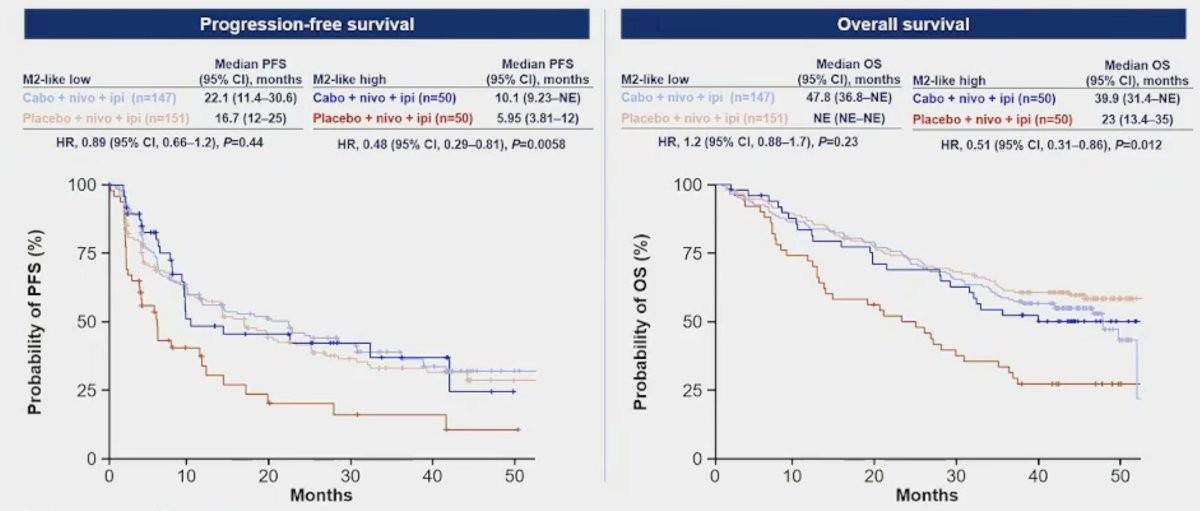
L’analyse des biomarqueurs n’a pas permis d’identifier un sous-groupe d’intérêt notamment concernant les niveaux initiaux de c-Met ou de PD-L1 même si une plus grande abondance de macrophages M2 était associée à une amélioration de l’OS sous traitement Cabozantinib, Nivolumab et Ipilimumab (HR=0,51 ; IC95% 0,31-0,86).
D’autres analyses exploratoires des signatures angiogéniques et immunitaires sont en cours.
EN PRATIQUE :
Avec ces données actualisées de l’étude COSMIC-313, l’utilisation d’un traitement associant Cabozantinib, Nivolumab et Ipilimumab en situation de 1ère ligne continue de bénéficier aux patients atteints de carcinome rénal avancé à risque intermédiaire ou élevé (survie sans progression et taux de réponse objective), les analyses de sous-groupes retrouvant un impact positif mais limité uniquement chez les malades à risque intermédiaire selon les critères IMDC. Aucune donnée de tolérance ne permet d’expliquer les résultats négatifs d’une intensification dans une population de risque défavorable. L’hypothèse la plus discutée serait la faible efficacité historique des inhibiteurs de tyrosine kinase ciblant le VEGFR chez les patients avec un IMDC défavorable, le doublet Nivolumab et Ipilimumab procurant strictement le même taux de réponse et la même médiane de survie sans progression dans les deux groupes pronostiques. Quoiqu’il en soit, l’absence d’amélioration de la survie globale ne soutient clairement pas l’usage des triplets en situation de 1ère ligne métastatique pour le moment, même si des essais sont en cours avec plusieurs associations intégrant d’autres immunothérapies (anti-LAG3, anti TIGIT) ou certaines molécules innovantes comme les inhibiteurs de HIF-2α avec le Belzutifan (LITESPARK-012).
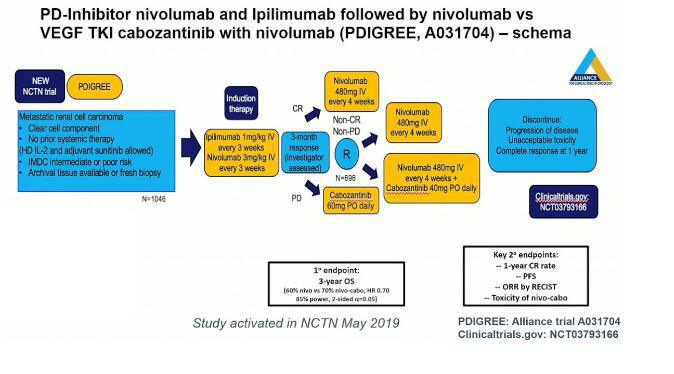
Une autre étude de phase 3 (PDIGREE), permettra peut-être de mettre en avant le concept d'une stratégie adaptative basée sur la réponse d’une combinaison d’immunothérapie avant l’ajout éventuel du Cabozantinib chez les patients avec réponse partielle ou maladie stable au décours d’une double immunothérapie par Nivolumab et Ipilimumab.
Cabozantinib plus Nivolumab and Ipilimumab in Renal-Cell Carcinoma | New England Journal of Medicine (nejm.org)
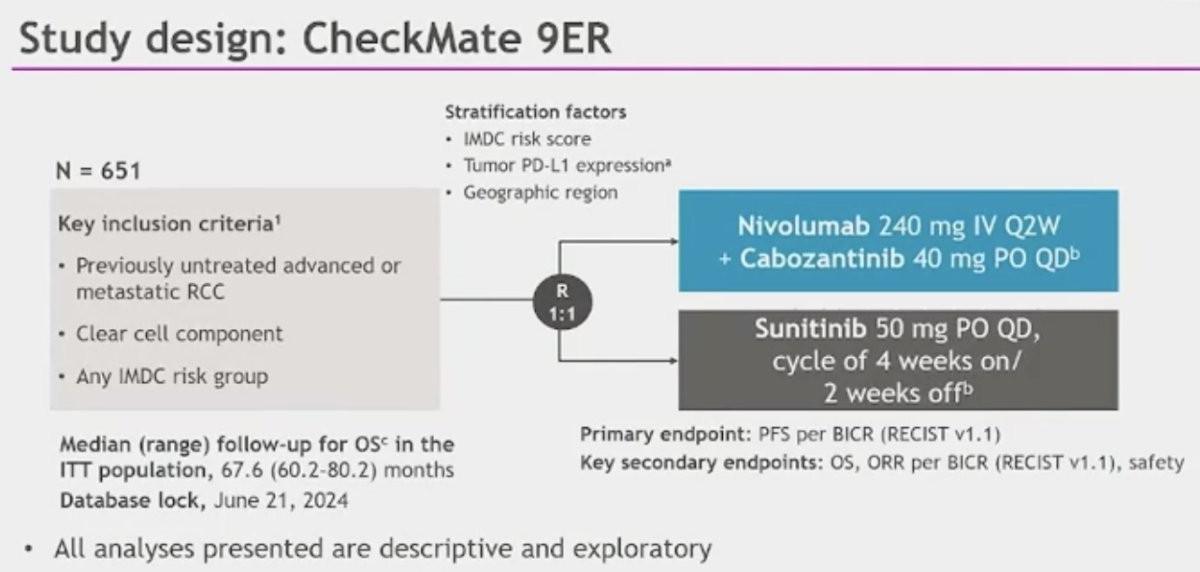
2) Résultats à plus de 5 ans de l’étude CheckMate 9ER s’intéressant à l’efficacité et à la tolérance du Nivolumab associé au Cabozantinib versus Sunitinib en 1ère ligne métastatique du carcinome rénal à cellules claires. (Abstract 439 ; Robert J. Motzer)
LE CONTEXTE :
Ces dernières années, la prise en charge thérapeutique du cancer du rein a connu une évolution majeure. La découverte des inhibiteurs de checkpoints immunitaires (anti-PD1/anti-PDL1 et anti-CTLA-4) a complètement révolutionné le paysage du carcinome à cellules rénales. L’immunothérapie d’abord utilisée en situation de 2ème ou 3ème ligne thérapeutique, est désormais présente dans tous les traitements standards de 1ère ligne métastatique sous la forme d’un doublet d’immunothérapie ou en association avec un inhibiteur de tyrosine kinase. En France, 4 associations sont désormais remboursées et validées en pratique courante avec le Pembrolizumab associé à l’Axitinib (étude KEYNOTE-426), le Nivolumab associé au Cabozantinib (étude CheckMate 9ER), le Pembrolizumab associé au Lenvatinib (étude CLEAR) et le Nivolumab associé à l’Ipilimumab (étude CheckMate 214). Lors du congrès de cette année, les données de l’étude CheckMate 9ER ont été actualisées avec un suivi à long terme (> 5 ans).
METHODES ET RESULTATS :
On rappelle que les patients atteints de carcinome rénal avancé et inclus de cette étude ont été randomisés en 2 groupes avec soit du Nivolumab (N) 240 mg toutes les 2 semaines associé au Cabozantinib 40 mg une fois par jour (n=323) soit du Sunitinib 50 mg/j (4 semaines sur 6 pour chaque cycle) (n=328), jusqu’à progression de la maladie ou toxicité inacceptable avec une durée maximale d’utilisation pour l’immunothérapie de 2 ans. Le critère principal était la survie sans progression (PFS) selon RECIST v1.1, évaluée par un comité indépendant en aveugle (BICR) et les critères secondaires étaient la survie globale (OS), le taux de réponse objective (ORR) selon RECIST v1.1 (BICR) et les données de tolérance.
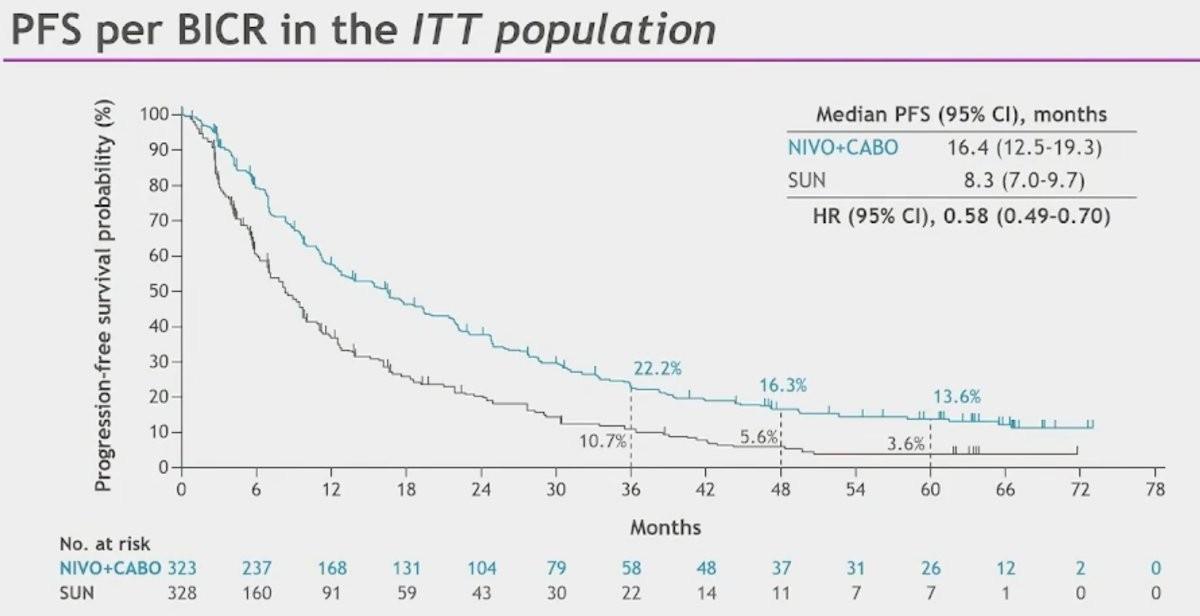
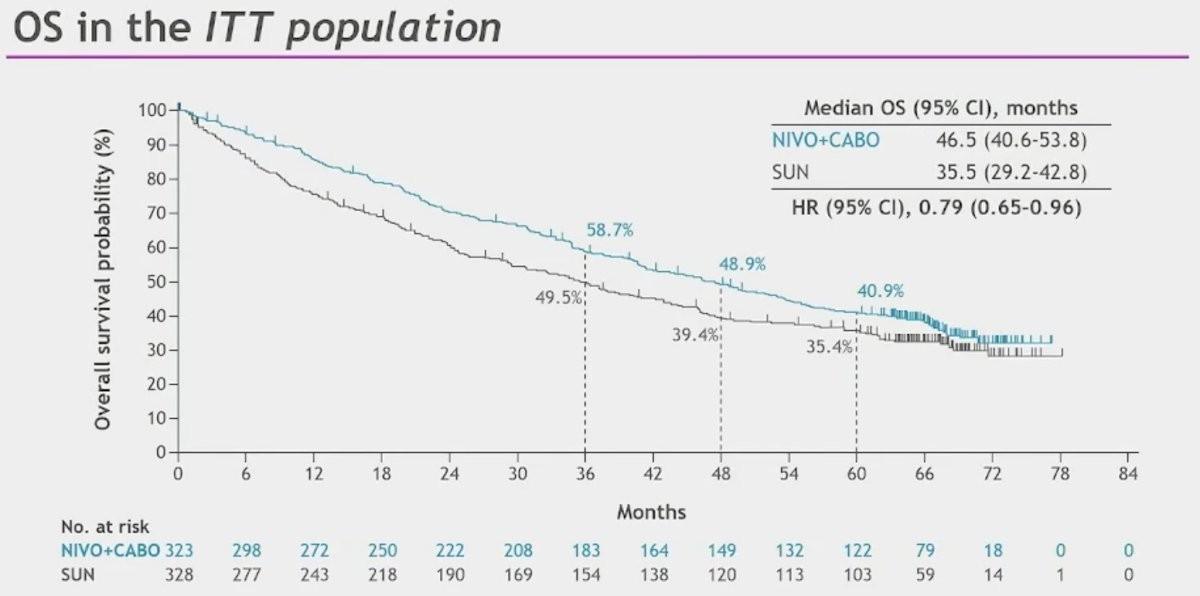
Avec un suivi de 67,6 mois, le bénéfice global en termes de survie sans progression (16,4 mois vs 8,3 mois ; HR= 0,58 ; IC95 % : 0,49–0,70) et en survie globale (46,5 mois vs 35,5 mois ; HR=0,79 ; IC95 % 0,65–0,96) en faveur du traitement expérimental s’est maintenu dans la population en ITT.
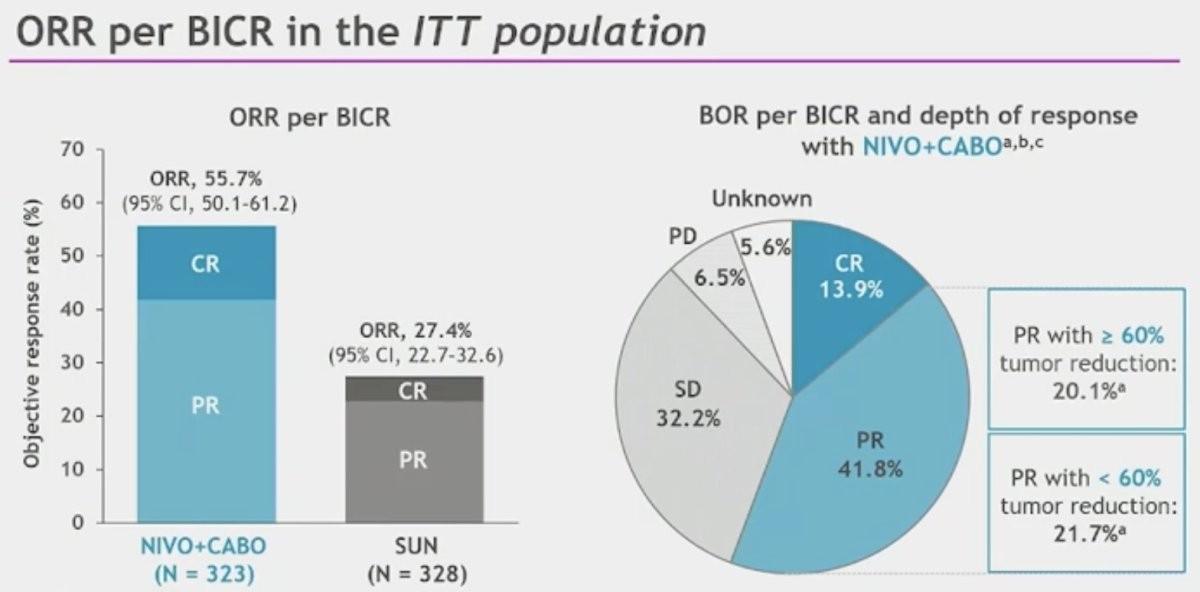
Le taux de PFS et d’OS à 60 mois étaient respectivement de 13,6% (vs 3,6%) et de 40,9% (vs 35,4%). Le taux de réponse objective sous Nivolumab et Cabozantinib était de 55,7 % (vs 27,4 %) dont 13,9 % de réponse complète (vs 4,6 %) avec un taux de durée de réponse à 60 mois de 22,0 % (vs 10%).
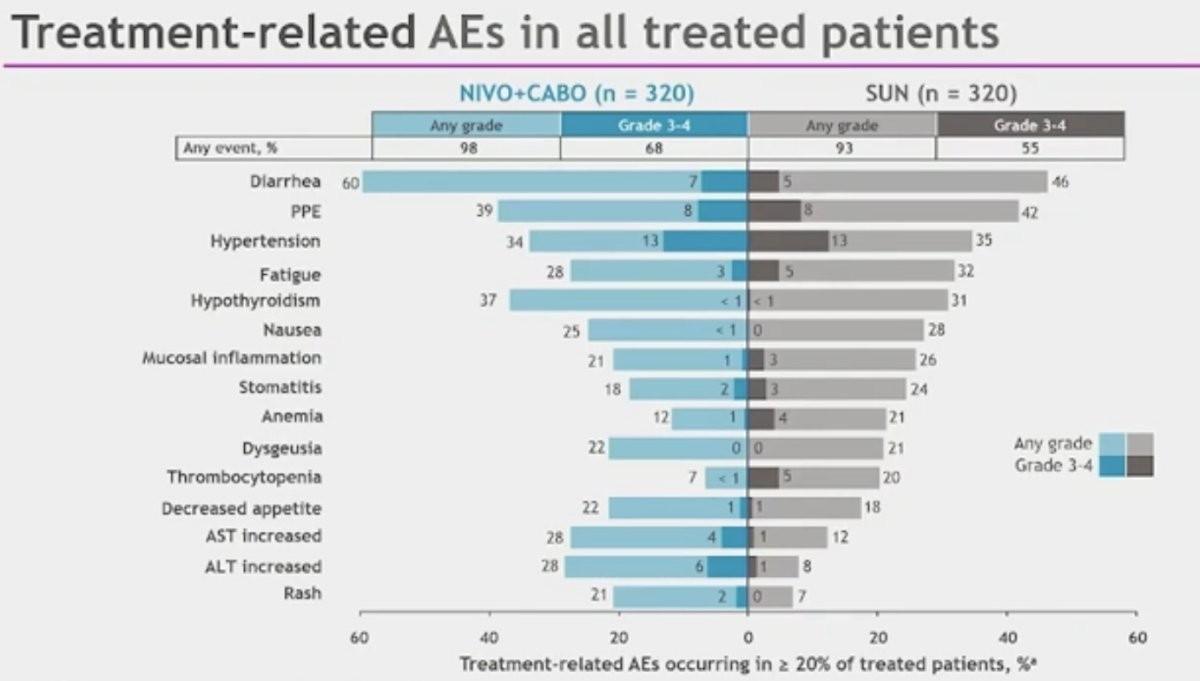
Concernant le profil de tolérance, il n’existait pas de nouveau signal défavorable en termes d’innocuité avec un taux d’effets indésirables liés au traitement de grades ≥ 3 de 67,8 % dans le bras expérimental versus 55,3% dans le bras Sunitinib. Aucun nouveau décès n’a été rapporté depuis la dernière mise à jour de la base de données.
EN PRATIQUE :
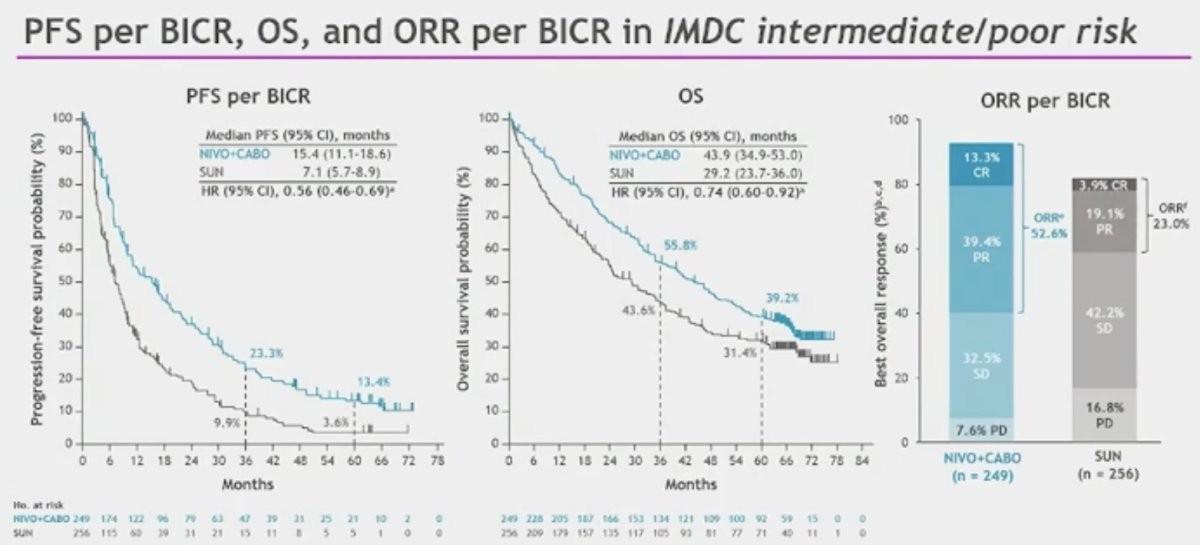
L’essai CheckMate 9ER, avec plus de 5 ans de suivi, confirme l'efficacité à long terme de l’association Nivolumab et Cabozantinib par rapport au Sunitinib, avec une amélioration significative en termes de PFS, OS et ORR, y compris dans les groupes à risque défavorable selon IMDC.
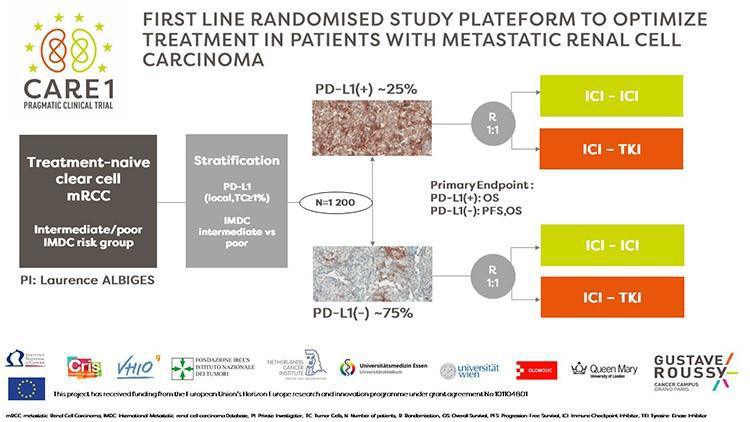
Aucun nouveau signal de sécurité n’a été détecté. Ces résultats renforcent ce traitement comme standard de 1ère ligne métastatique chez les patients atteints de carcinome rénal à cellules claires. Si aucune comparaison directe n’est possible avec les autres combinaisons consensuelles, qui avaient toutes comme bras comparateur un traitement par anti-angiogénique, l’étude des différents objectifs principaux ou secondaires et les analyses en sous-groupe restent également instructives pour guider le prescripteur dans son choix thérapeutique. D’autres éléments comme l’expérience du clinicien, le profil de toxicité de l’association et les facteurs liés à la maladie (sites métastatique, caractéristiques histologique, profil évolutif) et à ceux du patient, doivent également être pris en considération. La recherche de biomarqueurs prédictifs d’efficacité ou pronostiques pourrait également permettre de définir la stratégie thérapeutique la plus optimale. Un projet européen à grand échelle CARE-1 visera à optimiser le traitement de première ligne des patients atteints de cancers du rein métastatique via la mise en œuvre d’un biomarqueur de routine.
Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma | New England Journal of Medicine (nejm.org)
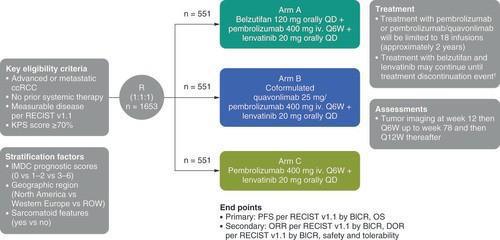
3) Données de l’étude de phase 1/2 KEYMAKER-U03 (sous-étude-03B) évaluant plusieurs combinaisons thérapeutiques chez des patients atteints de carcinome rénal à cellules claires avancé en progression après un traitement par inhibiteur de PD-(L)1 et VEGF-TKI. (Abstract 440 ; Katy Beckermann)
LE CONTEXTE :
L’amélioration de la prise en charge thérapeutique du cancer du rein avec des combinaisons de traitements utilisés auparavant dans le cadre d’une maladie plus avancée a paradoxalement créé un vide en situation de 2ème ligne métastatique. Les données randomisées pour soutenir la poursuite d’un inhibiteur de check-point immunitaire après l’échec d’un traitement de 1ère intention avec une immunothérapie faisaient encore défaut jusqu’aux résultats de l’étude CONTACT-03. Il s’agissait du premier essai randomisé de phase 3 évaluant l'efficacité et la tolérance d'un inhibiteur de PD-L1 chez des malades préalablement traités par immunothérapie. L'ajout d'Atezolizumab au Cabozantinib n’a pas montré de bénéfice clinique chez les patients atteints d'un carcinome rénal métastatique en progression après un traitement par inhibiteur de check-point. Les analyses de sous-groupes n'ont pas permis d’identifier de sous-groupe de malades pouvant bénéficier de cette association. Les résultats d’une étude de phase 3 similaire (TivoNivo-2) cette fois-ci avec le Tivozanib et Nivolumab (un anti-PD1) confirmaient malheureusement l’échec d’un rechallenge d’une immunothérapie avec un inhibiteur de tyrosine chez les patients en progression. Reste la possibilité de nouvelles associations avec d’autres immunothérapies ou des thérapies innovantes comme les inhibiteurs de HIF-2α. Dans ce contexte, La sous-étude 03B de l'essai de phase 1/2 KEYMAKER-U03 a été conçue pour évaluer plusieurs combinaisons avec du Pembrolizumab ou des agents expérimentaux chez des patients atteints de ccRCC et préalablement traités par immunothérapie et un TKI ciblant VEGF.
METHODES ET RESULTATS :
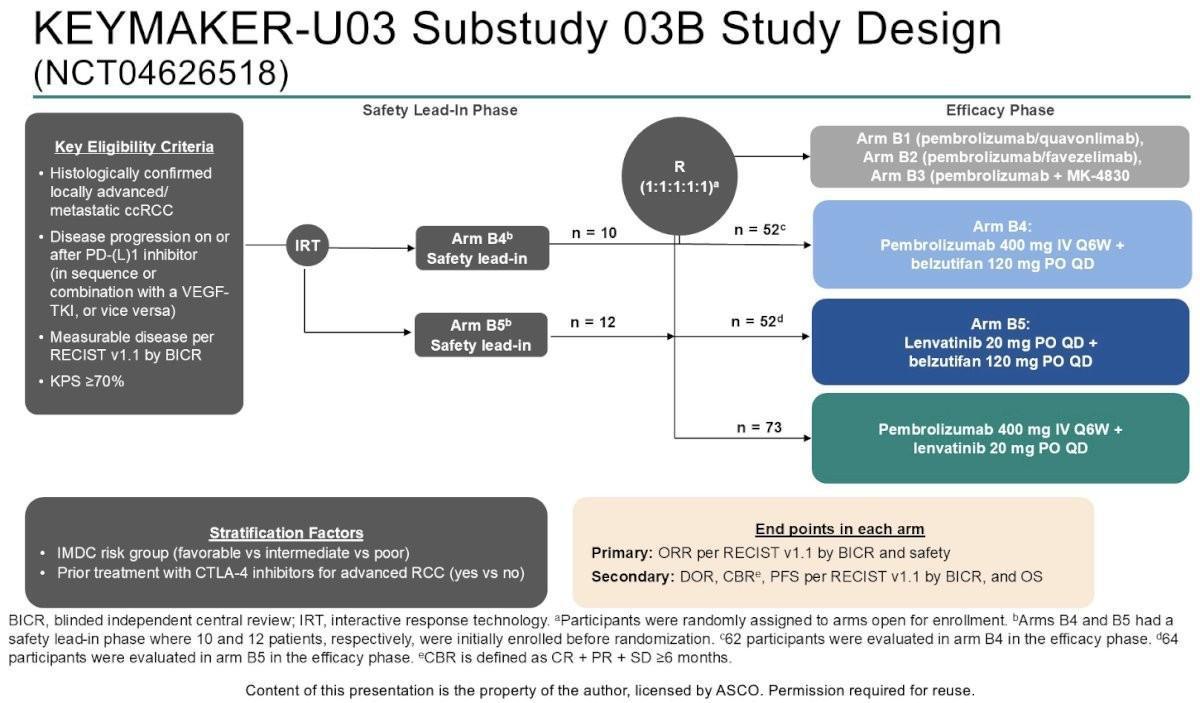
L’étude de phase 1/2 KEYMAKER-U03 (sous-étude-03B) évaluait plusieurs combinaisons thérapeutiques chez des patients atteints de carcinome rénal à cellules claires avancé en progression après un traitement par inhibiteur de PD-(L)1 et VEGF-TKI. Ils étaient randomisés (1:1) dans plusieurs bras contenant des thérapies ciblées avec le bras B4 comprenant le Pembrolizumab 400 mg IV toutes les 6 semaines et Belzutifan (120 mg/j), le bras B5 comprenant le Lenvatinib (20 mg/j) et Belzutifan ou le bras de référence comprenant le Pembrolizumab et Lenvatinib. Les critères d’évaluation principaux étaient les données de sécurité et le taux de réponse objective (ORR) selon RECIST v1.1, évalué par un comité indépendant en aveugle (BICR). Parmi les critères secondaires, on notait la durée de réponse, le taux de contrôle de la maladie, la survie sans progression (PFS) et la survie globale (OS).
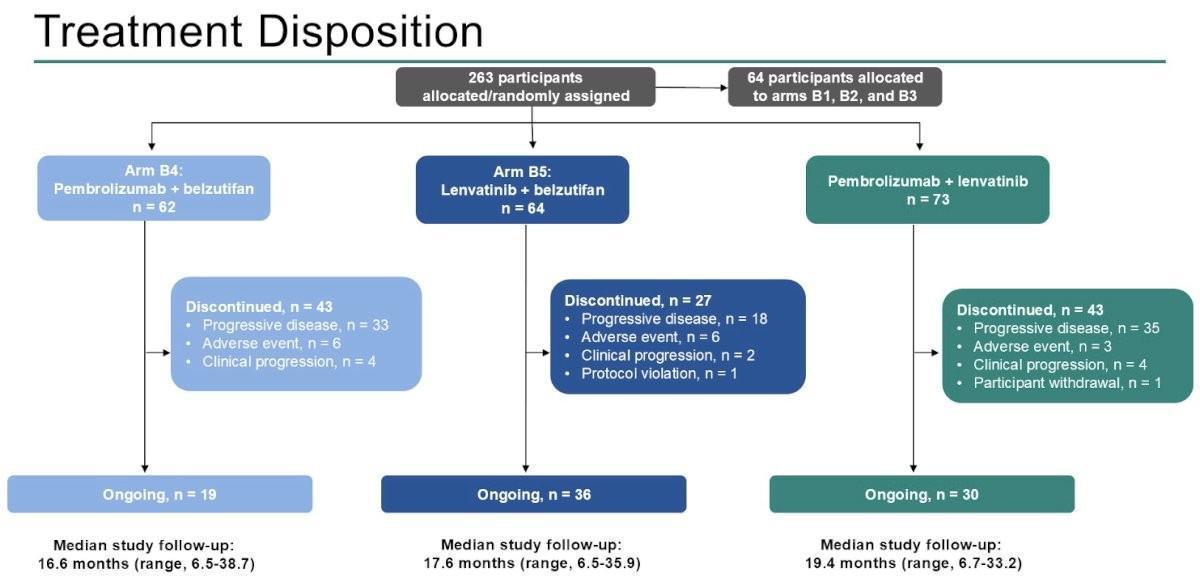
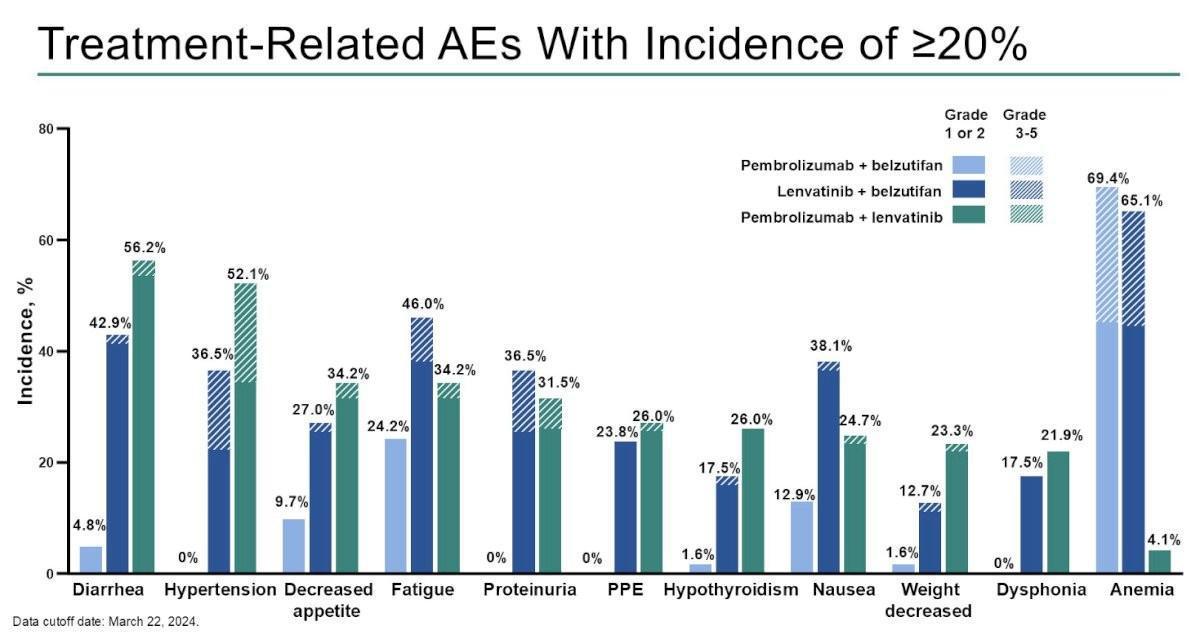
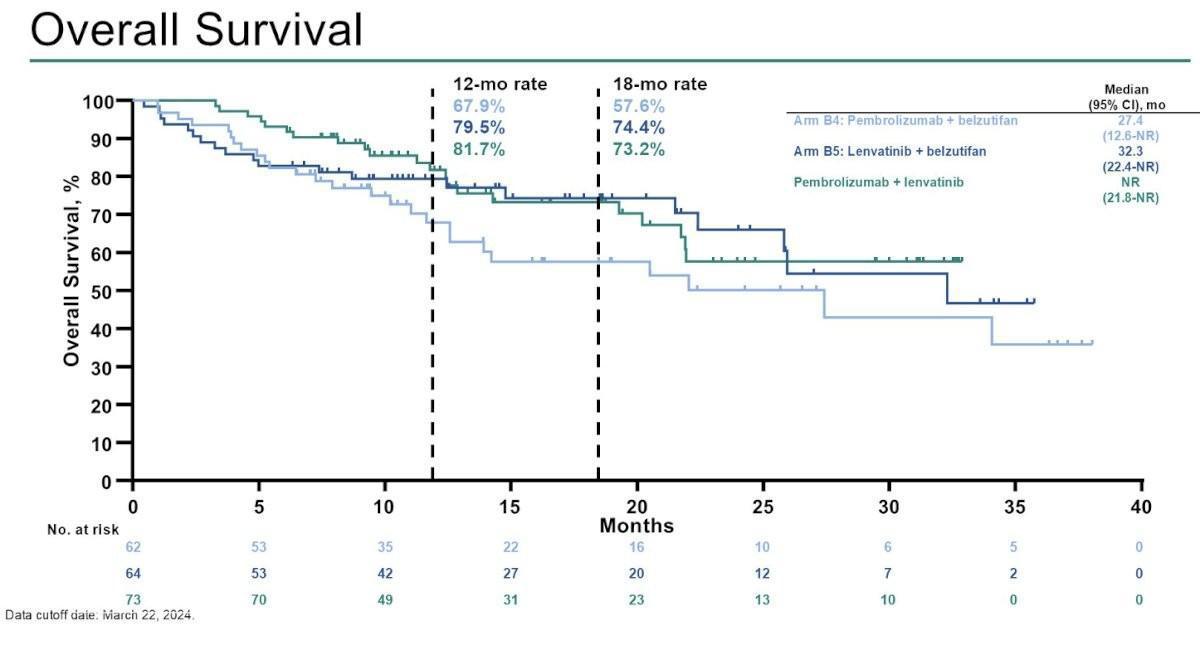
Le plan d’inclusion comportait initialement 50 patients par bras, avec un arrêt prévu si le taux de PFS à 6 mois était ≤40 %. Au final, 62 et 64 malades ont été inclus respectivement dans les bras B4 (Pembrolizumab + belzutifan) et B5 (Lenvatinib + Belzutifan) contre 73 patients dans le bras de référence.
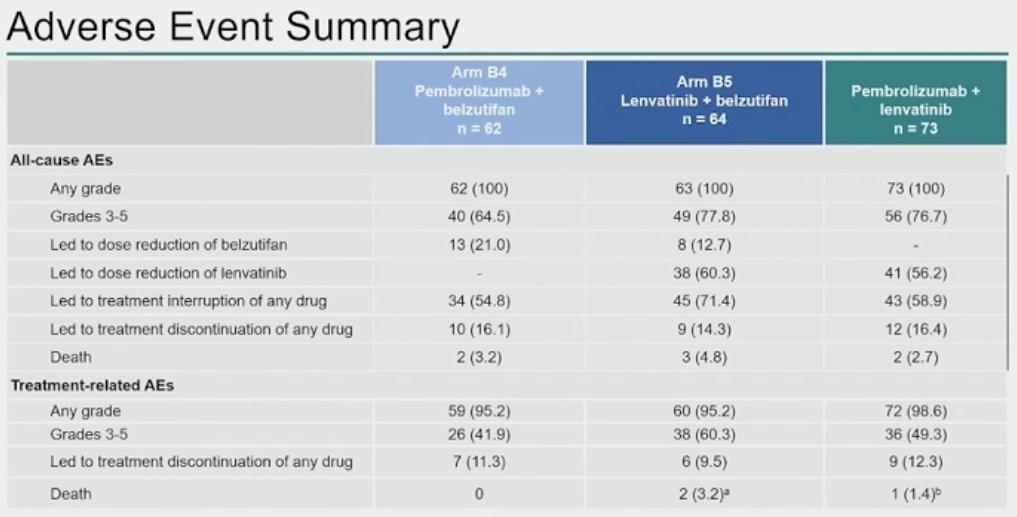
Avec des suivis médians respectifs de 16,6 mois (Bras B4), 17,6 mois (Bras B5) et 19,4 mois (Bras de référence), le taux d’effets indésirables de grades 3 à 5 étaient de 42 % (26/62 patients), 60 % (38/63 patients) et 49 % (36/73 patients) respectivement. Plusieurs décès liés au traitement ont été recensés avec 2 patients du bras B5 (hémorragie cérébrale, hémorragie intracrânienne) et 1 patient du bras de référence (perforation œsophagienne).
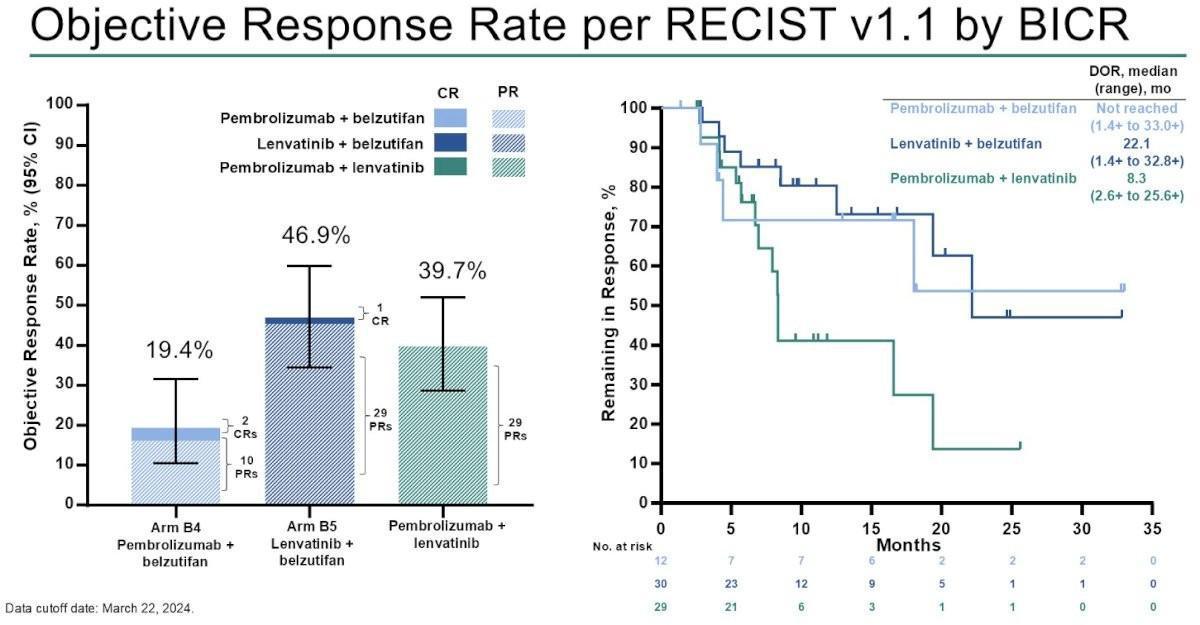
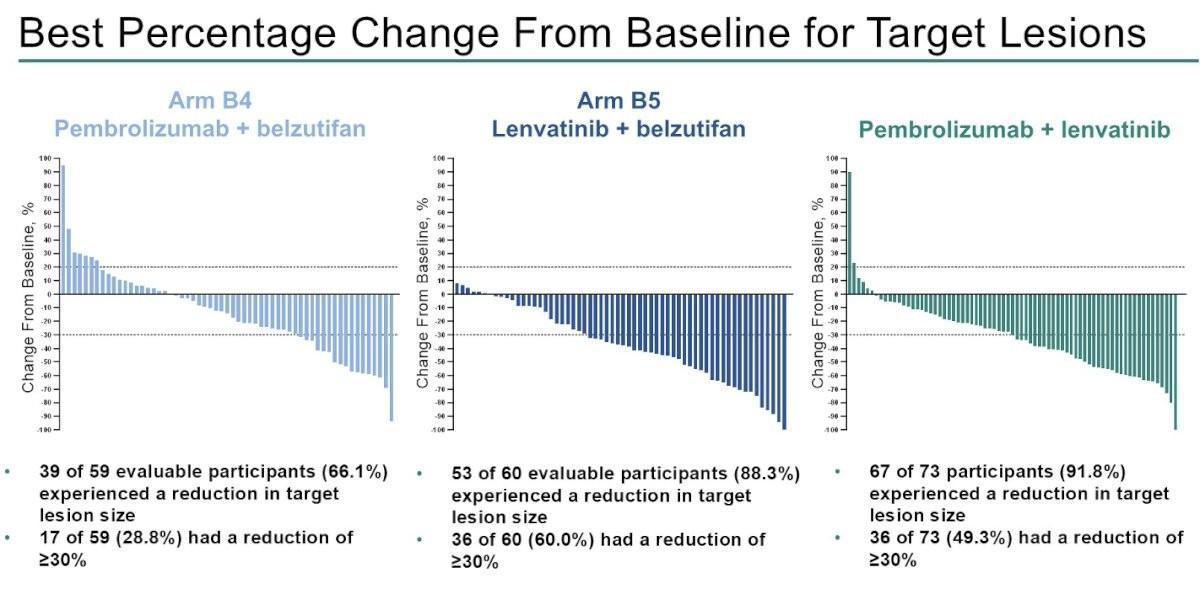
Concernant les données d’efficacité, on notait des taux de réponse objective de 19 % dans le bras B4, 47 % dans le bras B5 et 40 % dans le bras de référence. Le taux de bénéfice clinique était respectivement de 32 % (Bras B4), 59 % (Bras B5) et 58 % (Bras de référence) avec des durées médianes de réponse non atteintes sous Pembrolizumab et Belzutifan, 22,1 mois sous Belzutifan et Lenvatinib et 8,3 mois sous Pembrolizumab et Lenvatinib.
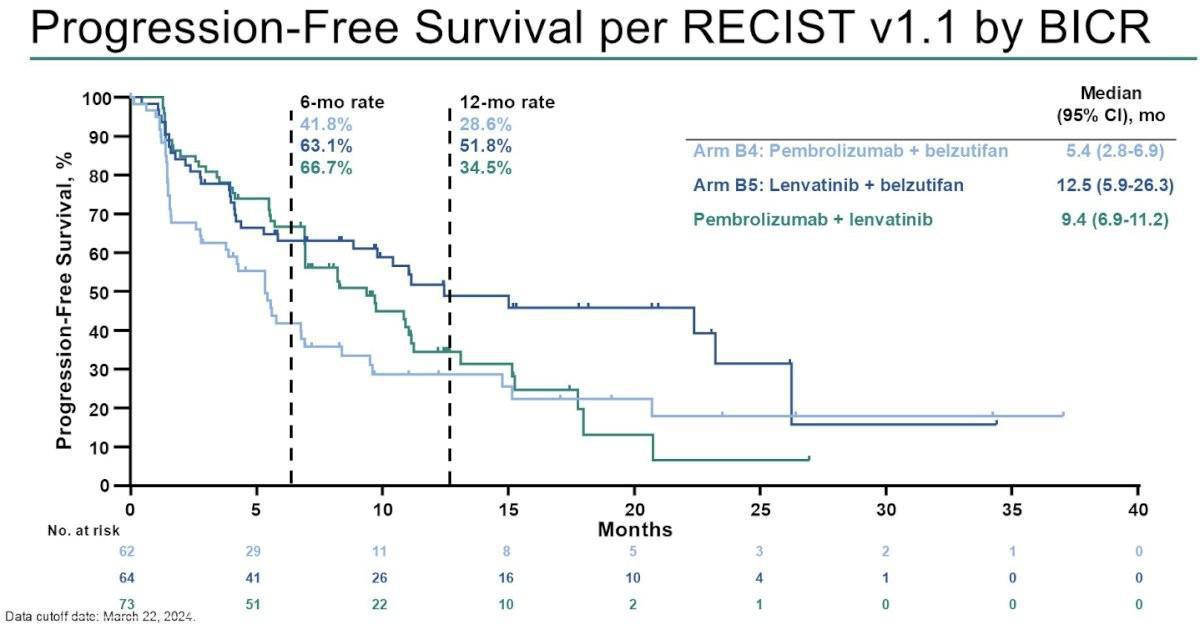
Les médianes de PFS et d’OS étaient respectivement de 5,4 mois (2,8–6,9), 12,5 mois (5,9–26,3) et 9,4 mois (6,9–11,2) et de 27,4 mois (12,6 mois-NR) et 32,3 mois (22,4–NR) (médiane d’OS non atteinte dans le bras de référence).
Les taux d’OS à 12 mois étaient de 68 % (Bras B4), 80 % (Bras B5) et 82 % (Bras de référence).
EN PRATIQUE :
Dans l’étude KEYMAKER-U03 évaluant plusieurs associations thérapeutiques chez des patients atteints de ccRCC et préalablement traités par immunothérapie et un TKI ciblant VEGF, La combinaison Lenvatinib et Belzutifan (bras B5) a démontré, une activité antitumorale prometteuse (ORR de 47%, taux de contrôle de la maladie de 59%) et durable (médiane de PFS prolongée de 12,5 mois avec taux de PFS à 12 mois de 51,8% et durée médiane de réponse de 22,1 mois) avec un profil de sécurité conforme aux éléments connus des 2 médicaments. Ces résultats soutiennent clairement l’exploration approfondie de la combinaison Lenvatinib et Belzutifan chez les patients atteints de ccRCC avancé, conformément à l’étude LITESPARK-011 (vs Cabozantinib). A suivre donc !
4) Evaluation du taux plasmatique de KIM-1 comme biomarqueur pronostique et prédictif chez les patients atteints de carcinome rénal à cellules claires métastatique : Analyse post-hoc de l’étude CheckMate 214. (Abstract 437 ; Wenxin Xu)
LE CONTEXTE :
Il semble désormais indispensable d’identifier un biomarqueur pertinent de routine pour éclairer la prise de décision thérapeutique du carcinome rénal, notamment en situation adjuvante. Ce raisonnement avait déjà fait l'objet d’une présentation lors du congrès de l’ASCO 2024 concernant l’utilisation d’un biomarqueur circulant (KIM-1) évaluée sur une analyse exploratoire et rétrospective de l’essai IMmotion010 qui semblait démontrer l’intérêt pronostique et prédictif de réponse à une immunothérapie adjuvante de cette protéine. Une analyse post-hoc de l’étude CheckMate-214 vient étayer cette hypothèse, cette fois ci au stade métastatique.
METHODES ET RESULTATS :
L’essai CheckMate 214 a confirmé la supériorité d’une combinaison d’immunothérapie (Nivolumab et Ipilimumab) par rapport au Sunitinib en situation de 1ère ligne métastatique du carcinome rénal à cellules claires, avec des résultats récemment consolidés après un suivi médian de 7,5 ans.
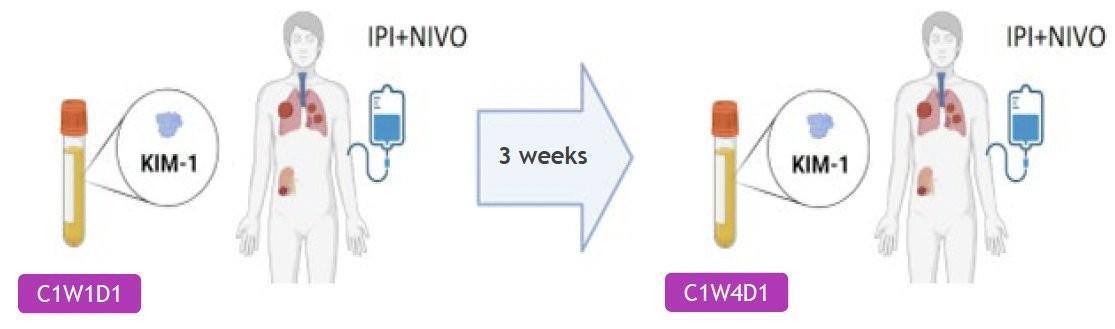
Dans cette analyse post-hoc, des tests d’électrochimiluminescence évaluaient les taux KIM-1 sur les échantillons plasmatiques disponibles à l’inclusion et 3 semaines après la 1ère dose d’immunothérapie ou un cycle de Sunitinib (50 mg/j, 4 semaines/6).
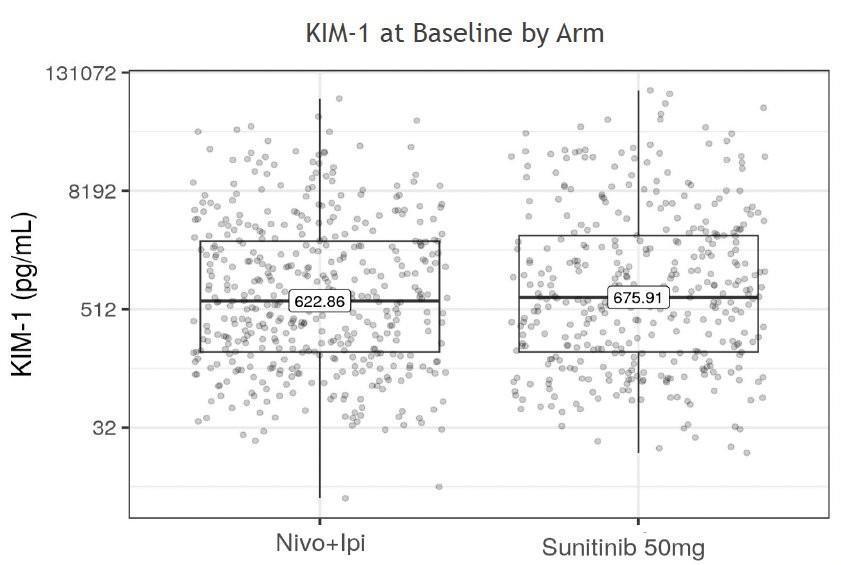
821 patients ont pu être analysés (soit 75 % de la population ITT de l’étude CheckMate 214) avec un taux médian de KIM-1 au départ (baseline) estimé à 622,8 pg/ml dans le bras Nivolumab + Ipilimumab et 675,91 pg/mL dans le bras Sutent.
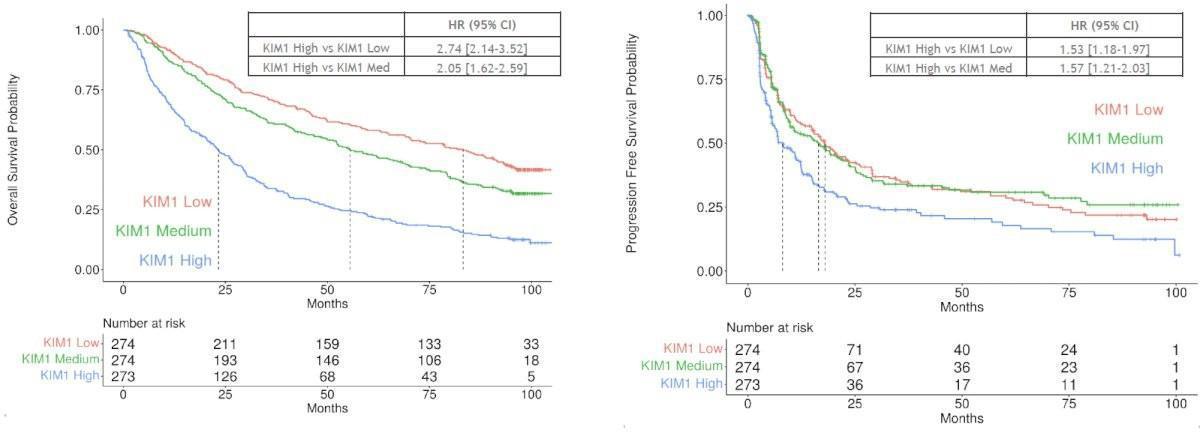
Il a été montre qu’un taux élevé de KIM-1 au départ était associé à une survie globale plus courte, quel que soit le groupe de risque IMDC, le statut de néphrectomie ou la charge tumorale. L’avantage de l’association Nivolumab et Ipilimumab par rapport au Sunitinib est observé dans tous les tertiles de KIM-1.
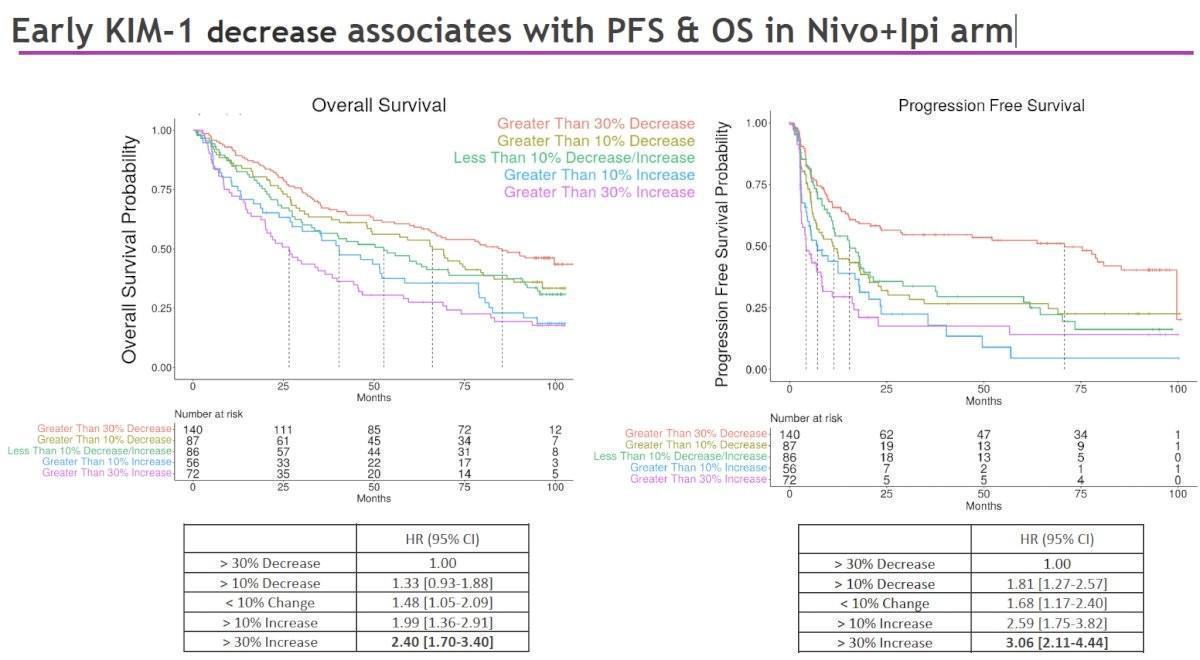
Concernant l’impact de la variation de KIM-1 à 3 semaines (avant la 2ᵉ dose) chez les patients sous immunothérapie, on constatait qu’une diminution ≥30 % de KIM-1 après la 1ère dose de traitement était fortement associée à une amélioration de la survie sans progression (PFS) (70,8 mois vs 4,2 mois si augmentation >30 % de KIM-1), de la survie globale (OS) (85,4 mois vs 26,6 mois) et du taux de réponse objective (ORR) plus élevé (69,3 % vs 13,9 %).
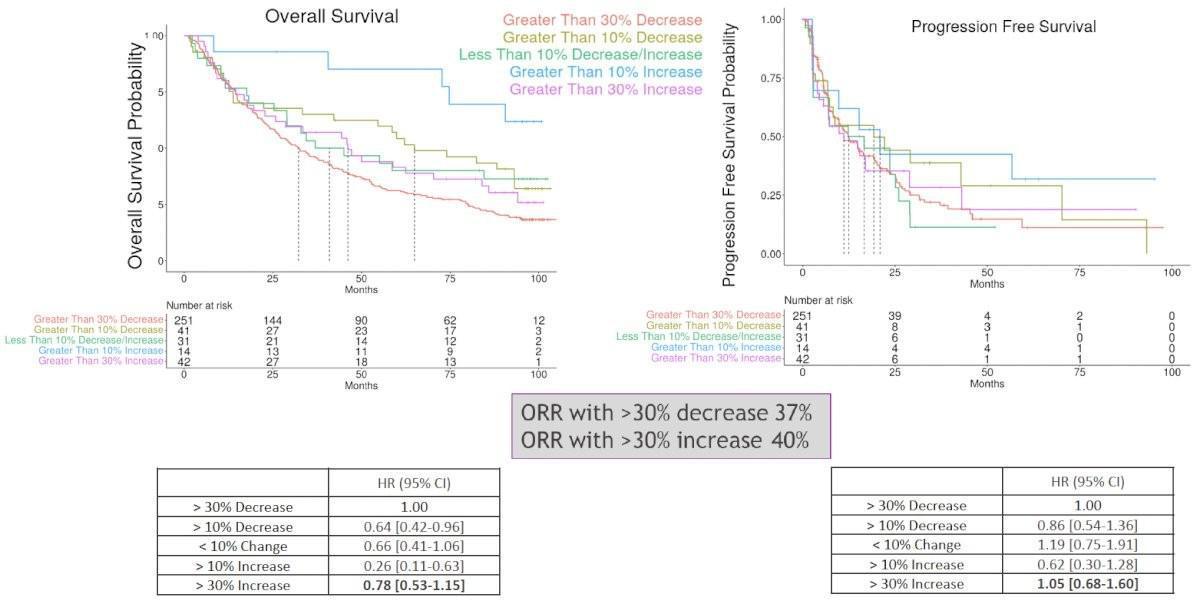
Aucune association similaire n’a été observée chez les patients traités par Sunitinib.
EN PRATIQUE :
Dans cette analyse post-hoc de l’étude CheckMate 214, un taux plasmatique élevé de KIM-1 au départ est associé à des résultats cliniques défavorables, quel que soit le traitement reçu. La variation du taux de KIM-1 après 3 semaines (avant la 2ᵉ dose) est fortement corrélée à une efficacité à long terme (PFS, OS, ORR) de l’immunothérapie. KIM-1 pourrait potentiellement servir de biomarqueur précoce et non invasif pour le suivi de l’efficacité de l’immunothérapie chez les patients atteints de carcinome rénal à cellules claires et permettre une adaptation rapide des stratégies thérapeutiques. Ces données devront être confirmées de manière prospective. Il sera aussi question de son accessibilité, sa reproductibilité et son coût.
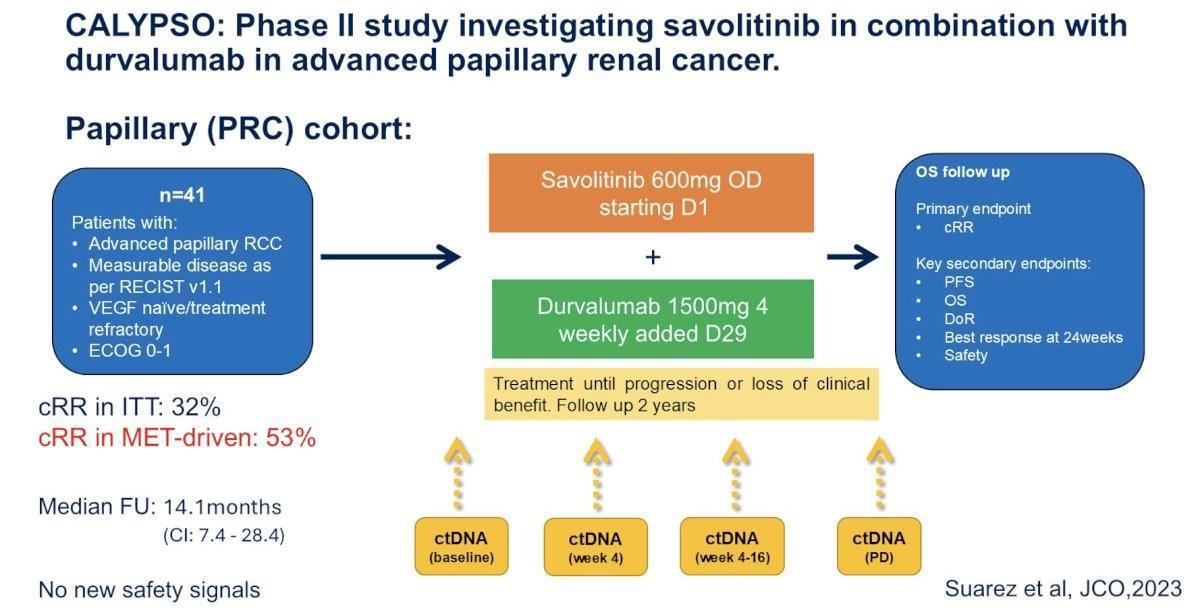
5) Données de survie globale et impact du suivi de l’ADN tumoral circulant de l’étude CALYPSO chez les patients atteints de carcinome rénal papillaire avancé avec dérégulation de la voie MET. (Abstract 444 ; Francesca Jackson-Spence)
LE CONTEXTE :
Le carcinome rénal non à cellules claires représente environ 20% des cancers du rein avec une prédominance pour le carcinome tubulo-papillaire. L’utilisation exponentielle des inhibiteurs de check-point en monothérapie ou combinaison chez les patients atteints de carcinome à cellules claires métastatique a naturellement incité à la recherche clinique concernant les autres entités tumorales rénales. Les données actualisées de l’étude KEYNOTE-B61 ont récemment confirmé le bénéfice de l’association Pembrolizumab et Lenvatinib avec une réponse tumorale significative dans tous les types de tumeurs (à un degré moindre pour le carcinome à cellules chromophobes) faisant de cette combinaison un standard thérapeutique de 1ère ligne chez les patients atteints d’un carcinome rénal non à cellules métastatique, en dépit d’études de larges effectifs qui restent difficiles à concevoir. A ce jour, l’utilisation de ces thérapies n’est pas clairement étayée par la biologie. L'inhibition du driver oncogénique MET est peut-être l'approche la plus logique dans ce cadre. L'ajout d’un antiPD-L1 à un ITK ciblant MET est renforcé par les résultats prometteurs de plusieurs phase 2 avec notamment l’étude CALYPSO qui retrouvait un taux de réponse objective de 53% en faveur du Durvalumab et Savolitinib (un inhibiteur multi-cibles dont MET) chez des patients atteints d’un carcinome papillaire métastatique. Les nouvelles données de cette phase 2 renforcent l’impact du bénéfice potentiel de l’association dans cette population spécifique.
METHODES ET RESULTATS :
Les patients inclus dans l’étude CALYPSO étaient atteints de carcinome rénal papillaire avancé, qu’ils soient naïfs de traitement ou prétraités. Ils recevaient du Durvalumab (1500 mg IV toutes les 4 semaines) et Savolitinib (600 mg/j) jusqu’à progression de la maladie, toxicité inacceptable ou retrait du consentement. Les critères d’évaluation de l’efficacité comportaient le taux de réponse objective selon RECIST 1 et les médianes de survie sans progression (PFS) et de Survie globale (OS).
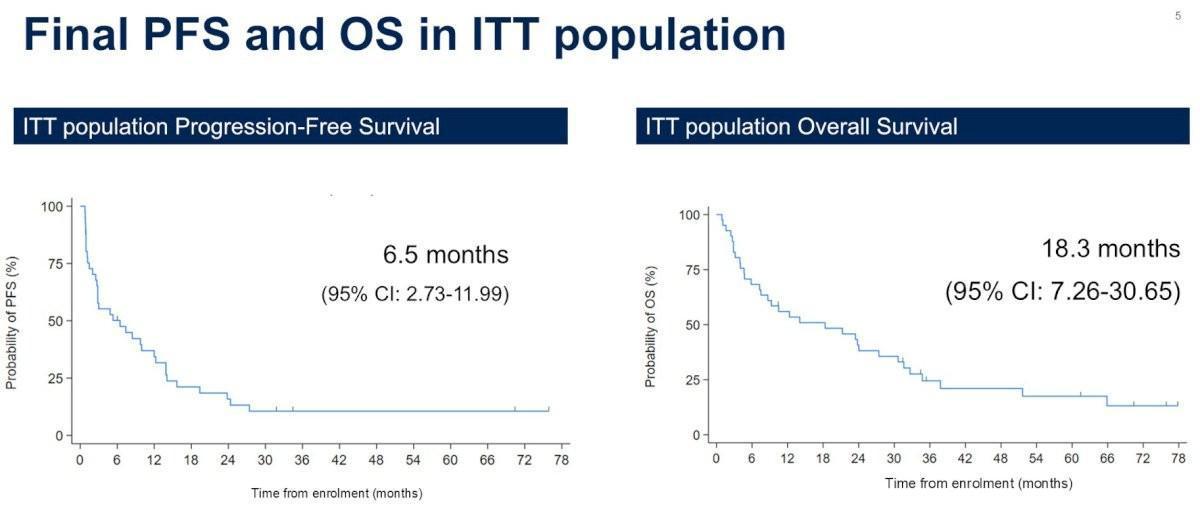
Une analyse de l’ADN tumoral circulant (ctDNA) a été effectuée par FoundationOne Tracker avec des prélèvements de plasma à l’inclusion et à différents temps du traitement. Avec un suivi médian de 41 mois, 41 malades ont été inclus dans la population en ITT avec un taux de réponse de 34 % (IC95 % 20–51 %) et des médianes respectives de PFS et d’OS de 6,5 mois (IC95 % 2,7-11,9 mois) et 18,3 mois (IC95 % : 7,3-30,6 mois).
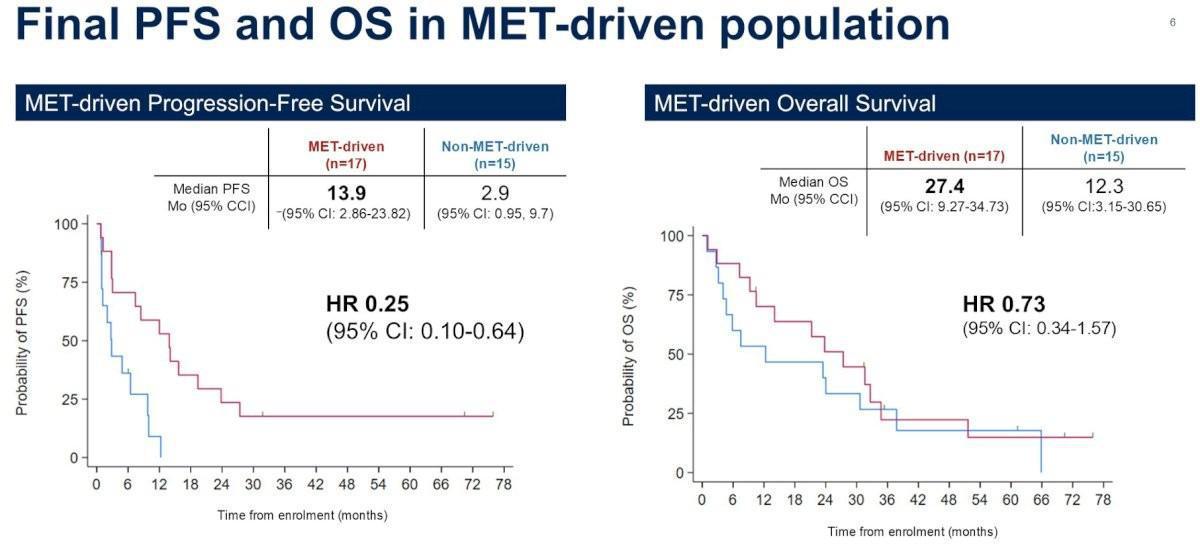
Chez les patients avec une dérégulation de la voie MET (n=17), le taux de réponse passait à 59% (IC95 % 33-82 %) avec des médianes de PFS et d’OS de 13,9 mois (IC 95 % 2,8-23,8 mois) et 27,4 mois (IC95 % 9,2-34,7 mois) respectivement. Il existait une différence significative en termes de PFS en fonction de (MET-driven vs Non-MET-driven) (13,9 mois vs 2,9 mois ; HR=0,25 ; IC95% 0,1-0,64) mais pas en termes de survie globale.
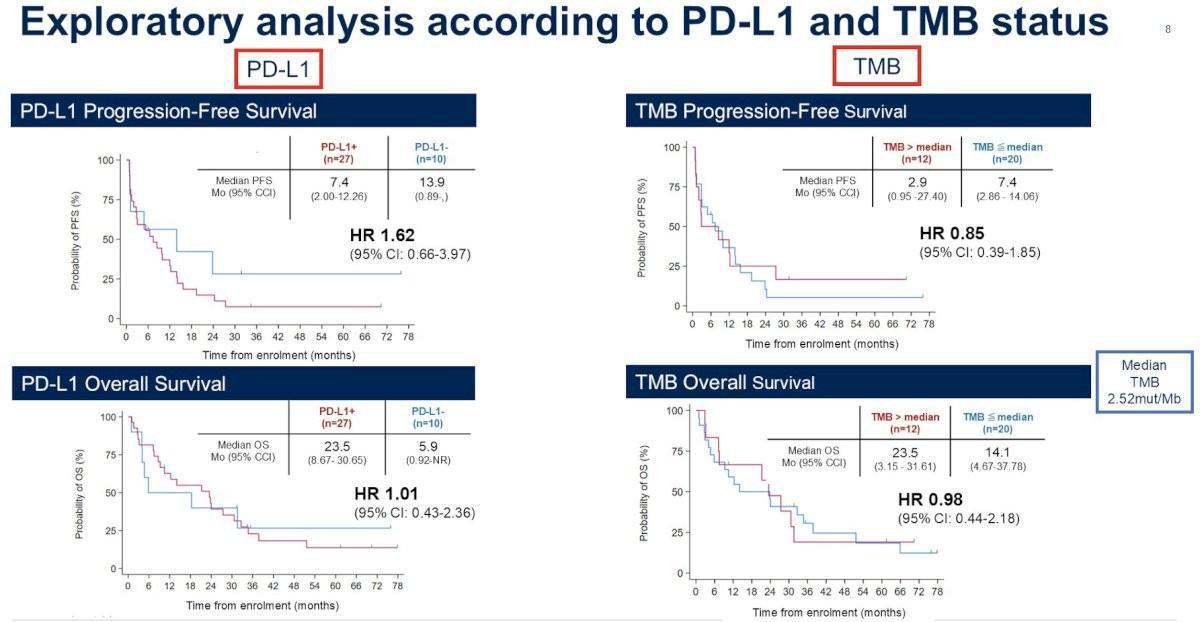
Des analyses complémentaires en fonction de l’expression tumorale de PD-L1 et de la charge mutationnelle (TMB) ont été réalisées, ne retrouvant pas d’amélioration notable de l’efficacité clinique du traitement.
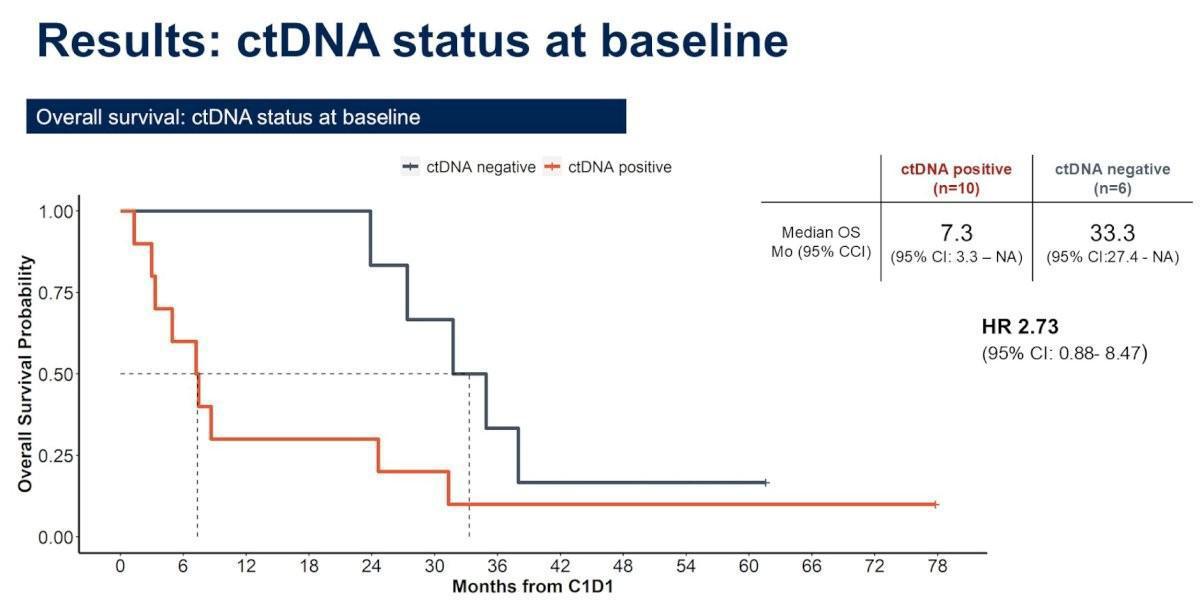
Concernant l’analyse exploratoire de l’ADN circulant tumoral, 48% des patients (10/21) étaient porteurs d’un ctDNA positif à l’inclusion (baseline) avec un impact négatif sur le taux de réponse (22% de répondeurs seulement) et la survie globale (7,3 mois vs 33,3 mois chez les malades avec un ctDNA négatif, HR 2,73 ; p=0,02).
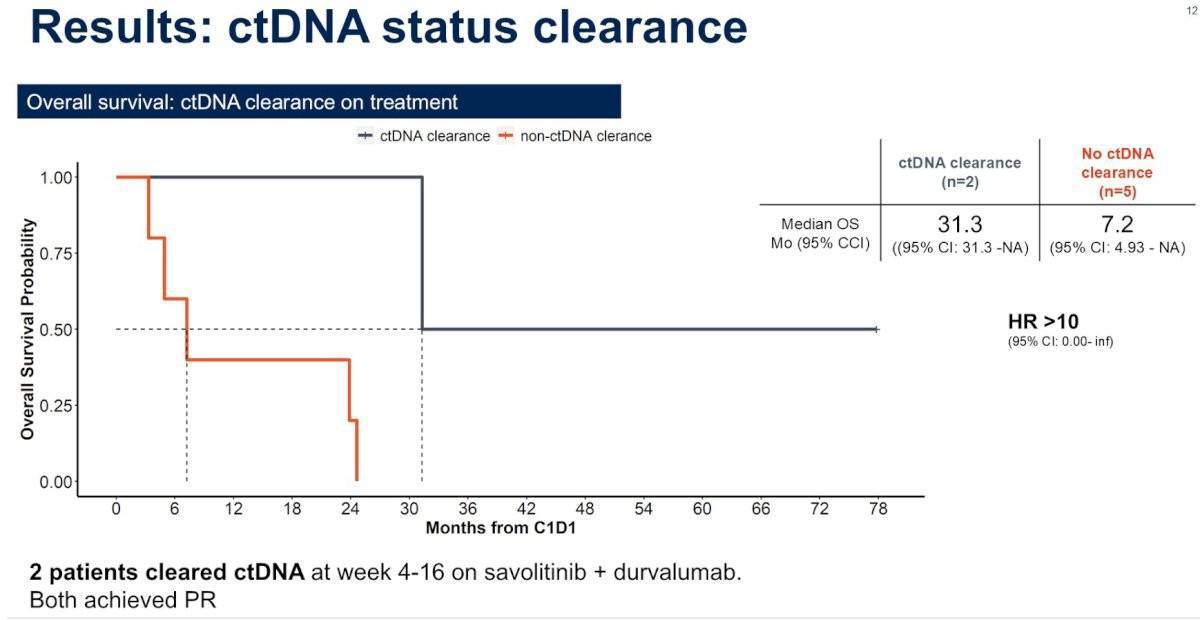
La variation du ctDNA sous traitement était corrélée à la réponse clinique avec une OS significativement plus longue chez les malades avec disparition complète du ctDNA (clearance).
EN PRATIQUE :
Avec cette actualisation des résultats de l’étude CALYPSO, l’association Durvalumab et Savolitinib maintient une efficacité notable chez les patients atteints de carcinome rénal papillaire avancé avec une dérégulation de la voie MET, renforçant la justification de l’essai de phase 3 SAMETA, actuellement en cours.
L’analyse du ctDNA au cours du traitement semble être un outil pronostique prometteur (survie global plus courte si ctDNA positif au départ) et pourrait aider à stratifier et adapter les traitements dans le carcinome rénal papillaire avancé (corrélation entre la variation du ctDNA sous traitement et réponse clinique).
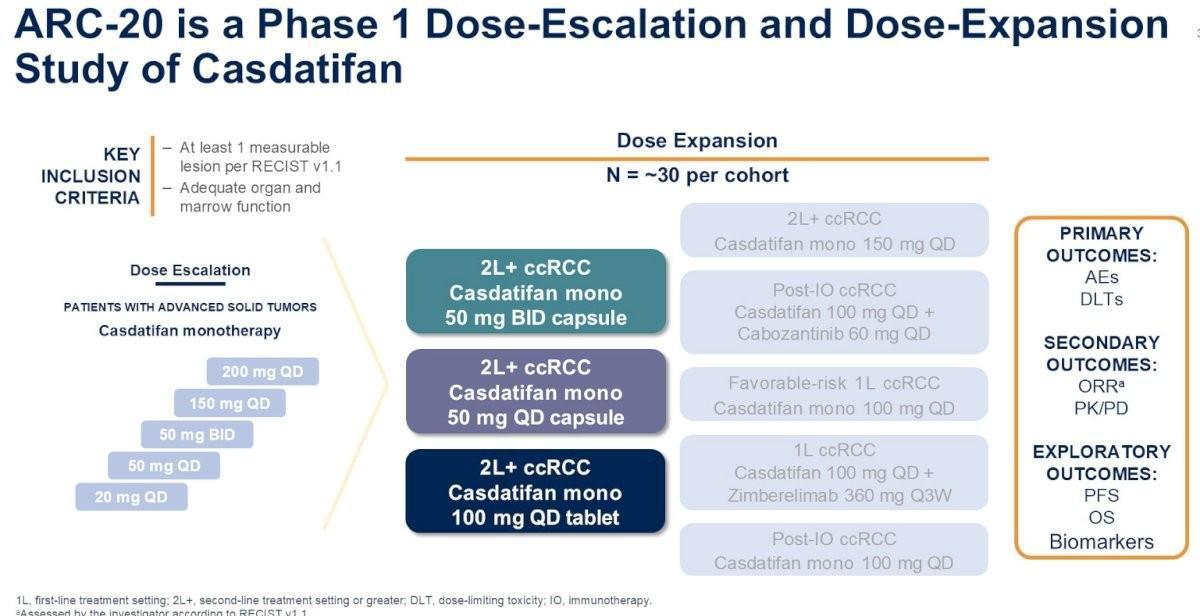
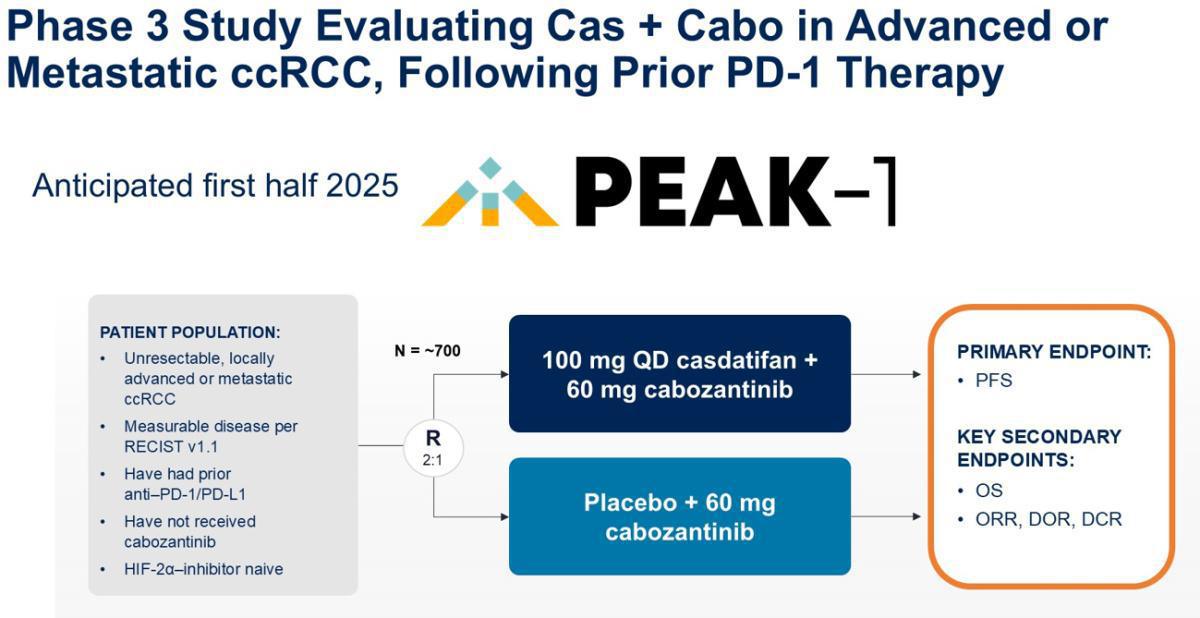
6) Données préliminaires d’une étude de phase 1 (ARC-20) d’expansion de dose évaluant l’efficacité et la tolérance du Casdatifan en monothérapie chez des patients atteints d’un carcinome rénal à cellules claire métastatique, prétraités. (Abstract 441 ; Toni K. Choueiri)
LE CONTEXTE :
Le rôle central de la voie VHL/HIF-VEGF est bien établi dans le processus de cancérogenèse du carcinome rénal et a contribué à l’utilisation des inhibiteurs de tyrosine kinase ciblant VEGFR. Une autre cible potentielle concerne la protéine HIF-2α (hypoxia-inductible factor-2α), un facteur de transcription naturellement surexprimé une situation d’hypoxie conduisant à l’angiogénèse. Le Belzutifan, un inhibiteur sélectif HIF-2α qui bloque l'hétéro-dimérisation de HIF-2α avec HIF-1β, stoppant l’activation des gènes impliqués dans la carcinogénèse a fait l’objet de plusieurs présentations ces derniers mois (LITESPARK-005) et pourrait potentiellement enrichir notre arsenal thérapeutique chez les patients atteints d’un carcinome rénal métastatique préalablement traité par une immunothérapie où il existe avec un besoin impérieux de nouvelles ressources thérapeutiques.
D’autres inhibiteurs de HIF-2α sont à l’étude avec les premières données préliminaires d’efficacité et de tolérance comme le DFF332, HS-10516, NKT2152 ou le Casdatifan. Ce dernier a fait l’objet d’une présentation lors de la dernière journée du congrès de l’ASCO-GU, dans une étude de phase 1 (ARC-20)
METHODES ET RESULTATS :
L’essai ARC-20 était une étude de phase 1, ouverte, évaluant l’efficacité et la tolérance du Casdatifan, un inhibiteur de HIF-2α sous la forme d’une petite molécule administrée par voie orale, qui bloque efficacement la transcription des gènes dépendant de HIF-2α. Les patients inclus de ≥18 ans étaient atteints de carcinome rénal à cellules claires, naïfs d’inhibiteurs de HIF-2α et préalablement traités par anti-PD-(L)1 et inhibiteurs de tyrosine kinase ciblant VEGFR. Les critères d’évaluation principaux étaient l’incidence des effets indésirables liés au traitement (TEAEs) et le taux de réponse objective (ORR) selon RECIST v1.1
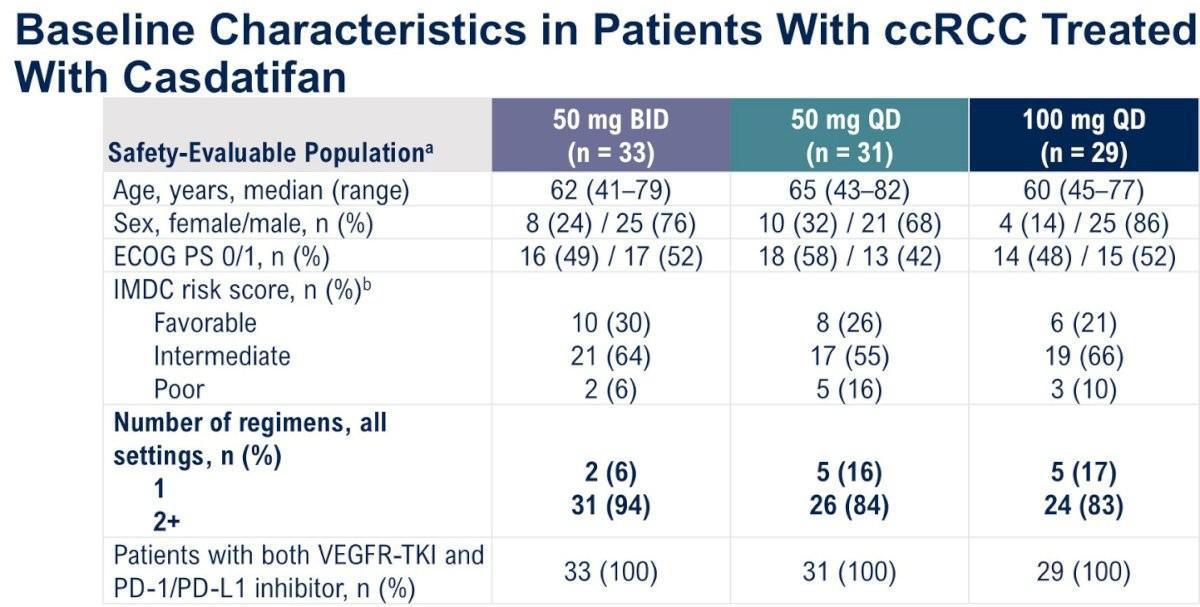
Après une phase d’escalade de dose permettant de s’assurer de l’innocuité du traitement, 93 patients ont été inclus dans une phase d’expansion de dose (33 malades à la dose de 50 mg 2x/j, 31 à la dose de 50 mg/j et 29 à la dose de 100 mg 2x/j). Le nombre médian de lignes de traitement antérieures étaient de 3 (1-7) dans une population homogène dans les 3 cohortes.
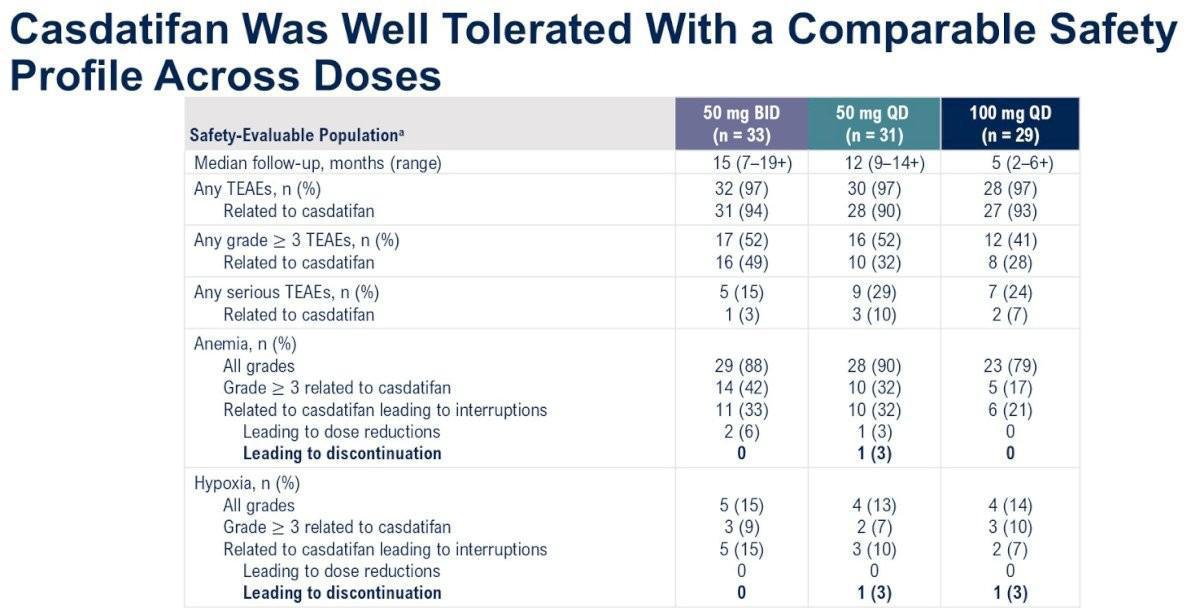
Concernant les données de tolérance, on notait un taux d’effets indésirables liés au traitement (TEAEs) de Grades ≥3 de l’ordre de 40 à 50% selon des doses reçues avec notamment un effet de classe bien identifié chez les inhibiteurs de HIF-2α comme une anémie (36% tous bras, toutes doses) et une hypoxie. Aucun effet indésirable de Grade ≥4 n’a été observé.
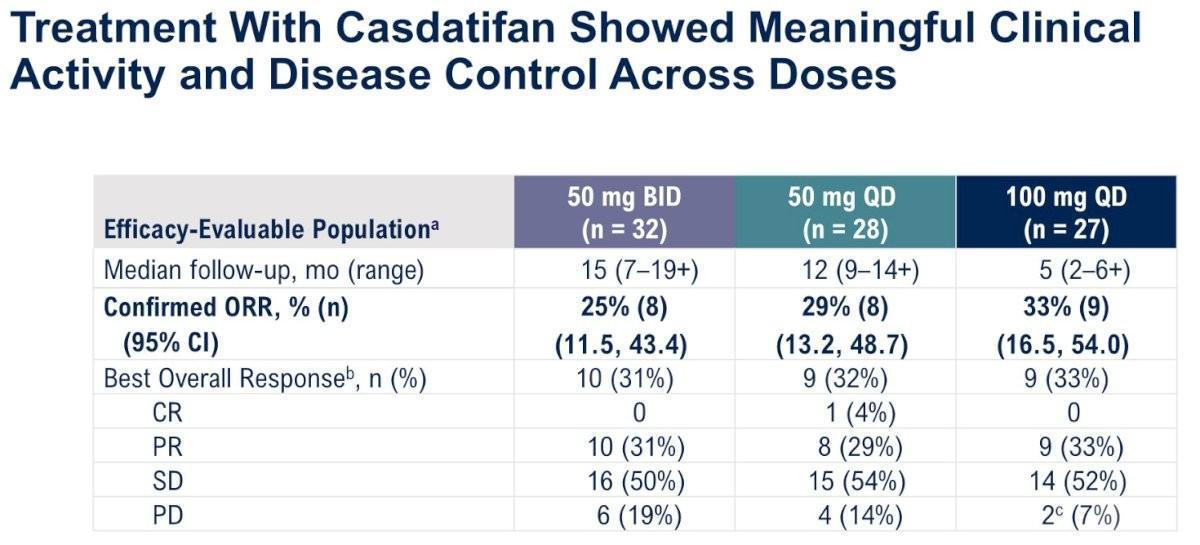
Avec des suivis médians respectifs de 15, 12 et 5 mois selon les cohortes, des réponses ont été observées dans tous les groupes de risque selon IMDC, quelle que soit la dose reçue, avec/sans traitement antérieur par inhibiteur mTOR (ORR de 25% à 50 mg/j, 29% à 50 mg 2x/j et 33% à 100 mg 2x/j). On notait également des taux de contrôle de la maladie > 80% dans les 3 cohortes.
Les résultats exploratoires d’efficacité (PFS et OS) et des analyses de biomarqueurs complémentaires (Immunohistochimie de HIF-1α et HIF-2α, mutations VHL et gènes liés au carcinome rénale, signatures transcriptomiques prédictives) sont en attente.
EN PRATIQUE :
Le Casdatifan a démontré une activité prometteuse en termes de contrôle de la maladie chez des patients atteints de carcinome rénal à cellules claires métastatique et lourdement prétraités, avec un profil de tolérance tout à fait correcte. Ces données encourageantes soutiennent la faisabilité de phase 3 avec des effectifs de plus grande ampleur. Dans ce contexte, une étude de phase 3 (PEAK-1) évaluera prochainement l’efficacité et la tolérance de cet inhibiteur de HIF-2α à la dose retenue de 100 mg 2 fois par jour associé au Cabozantinib chez des malades préalablement traités par anti-PD-(L)1.
Un essai clinique en situation de 1ère ligne métastatique avec le Volrustomig, un anticorps bi-spécifique ciblant PD-1 et CTLA-4, est également à venir.
7) Lenvatinib et Tislelizumab en 1ère ligne métastatique pour les patients atteints de carcinome rénal déficient en FH (Fumarate Hydratase) : Données d’une cohorte prospective de phase 2. (Abstract 443 ; Wen Kong)
LE CONTEXTE :
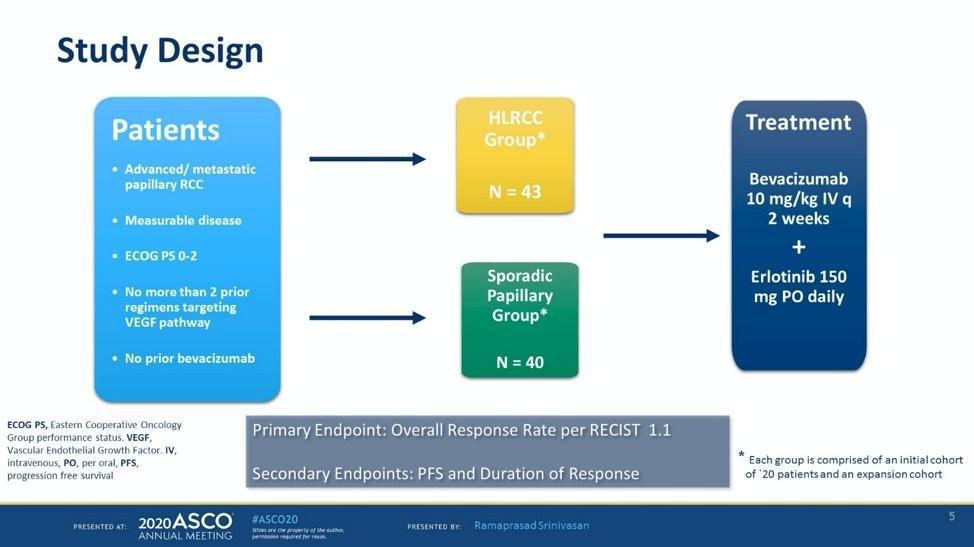
Le carcinome rénal déficient en FH (Fumarate Hydratase) est un sous-type de cancer du rein rare et particulièrement agressif dont la compréhension des altérations moléculaires, de la pathogenèse, des données de survie et de l'efficacité des traitements systémique reste limité. Il est généralement associé au syndrome de Léiomyomatose Héréditaire et de Carcinome Rénal (HLRCC) caractérisé par une mutation germinale de FH ou une perte de FH somatique bi-allélique sans altération de la lignée germinale. En raison de la faible incidence de cette maladie, des essais cliniques sont difficiles à mener et il n’existe pas de standard thérapeutique pour les patients atteints bien que certaines sociétés savantes recommandent l’utilisation du Bevacizumab associé à l’Erlotinib comme option de traitement.
Plusieurs combinaisons d’inhibiteurs de check-point immunitaire et d’inhibiteurs de tyrosine kinase (ITK) ont récemment été approuvées comment traitement de 1ère ligne pour la prise en charge du carcinome rénal à cellules claires. Cependant, on sait peu de choses sur l'activité de ces associations chez les malades atteints de carcinome rénal déficient en FH, en dehors de petites cohortes rétrospectives. Le Tislelizumab, un anti-PD1 a récemment été évalué dans cette population en association avec le Lenvatinib avec la présentation des 1ères résultats d’un essai de phase 2.
METHODES ET RESULTATS :
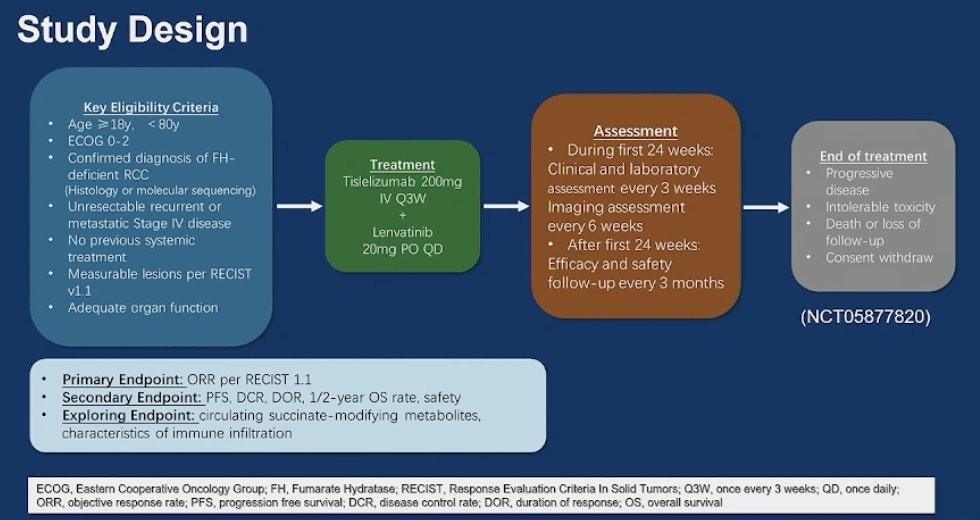
Cette étude s’intéressait à l’efficacité et la tolérance d’un traitement associant le Lenvatinib (20 mg/j) et le Tislelizumab (200 mg par voie intraveineuse, toutes les 3 semaines) en première ligne chez des patients atteints de carcinome rénal déficient en FH avancé ou métastatique, non résécable, confirmé par la présence de mutations germinales ou somatiques de FH (détectées par séquençage d’ADN) et présentant une maladie mesurable selon les critères RECIST 1.1. Cette association était poursuivie jusqu’à progression de la maladie, toxicité inacceptable ou retrait du consentement. Le critère de jugement principal était le taux de réponse objective (ORR) selon RECIST v1.1. Le taux de contrôle de la maladie, survie sans progression (PFS), durée de réponse objective, les taux de survie globale (OS) à 1 an et 2 ans et le profil de tolérance constituaient les objectifs secondaires de cet essai.
20 patients ont été inclus entre septembre 2023 et octobre 2024 (16 hommes et 4 femmes) avec un âge médian de 41 ans (24–62 ans). 15 malades étaient porteurs d’une mutation germinale de FH : 12 patients et 4 avec une mutation somatique bi-allèlique de FH (1 cas non évaluable).
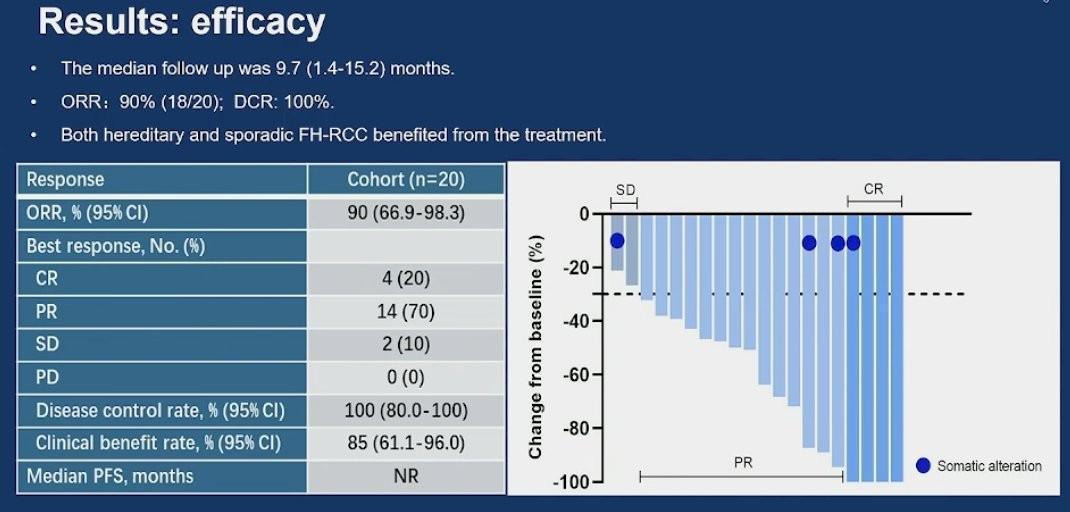
Avec une durée médiane de suivi de 9,7 mois, le taux de réponse objective était de 90 % (18/20 patients) dont 20% de réponse complète 20,0 % et un taux de contrôle de la maladie de 100%. Les médianes de PFS et d’OS n’étaient pas atteintes au cut-off avec un taux de PFS et d’OS à 6 mois de 85% et de 100 % respectivement.
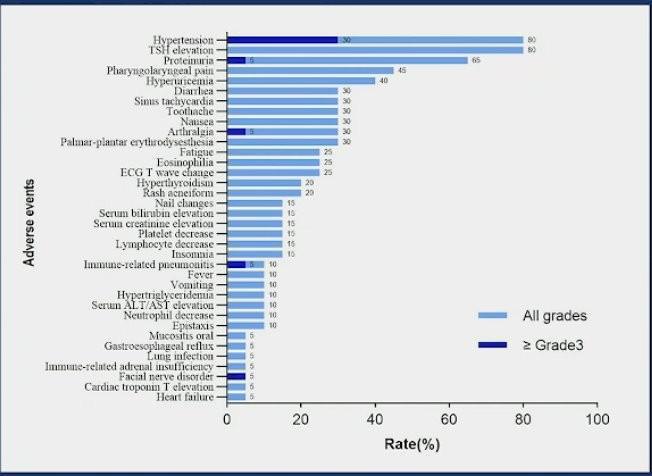
Concernant le profil de tolérance, on notait un taux d’évènement indésirables liés au traitement de 45% (9/20) avec un arrêt ou une réduction de dose chez 9 malades.
EN PRATIQUE :
La combinaison Lenvatinib et Tislelizumab a démontré une efficacité anti-tumorale prometteuse (ORR de 90 % avec 20 % de réponse complète) avec un profil de tolérance acceptable dans cette petite cohorte prospective. Ces résultats suggèrent qu’un traitement associant une immunothérapie et inhibiteur de tyrosine kinase peut être envisagé comme une option de 1ère ligne métastatique pour les patients atteints de carcinome rénal déficient en FH, une entité rare et potentiellement agressive. Une évaluation plus approfondie est nécessaire pour confirmer son rôle comme un futur standard thérapeutique.